麻风分枝杆菌(麻风杆菌)(mycobacterium leprae),是麻风的病原菌,系由挪威学者汉森于1873年发现。1879年德国学者奈瑟等用抗酸染色法予以确认。
一、麻风杆菌的形态和染色特点
麻风皮肤组织切刮液涂片经齐-尼(Ziehl-NeelSen,Z-N)法抗酸染色后,在光学显微镜下观察,麻风杆菌呈红色。完整的麻风杆菌染色均匀,一般呈短小直棒状,或稍有弯曲。麻风杆菌的形态呈多形性,除上述完整均匀染色菌外,尚可见到断裂状、短杆状、串珠状、双球状和颗粒状等变形菌(下图)。英国学者Rees等(1962年)以光学显微镜和电子显微镜进行对比观察结果认为,染色完整均匀菌是活菌,染色不均匀、菌体呈断裂状或颗粒状的杆菌为死菌。
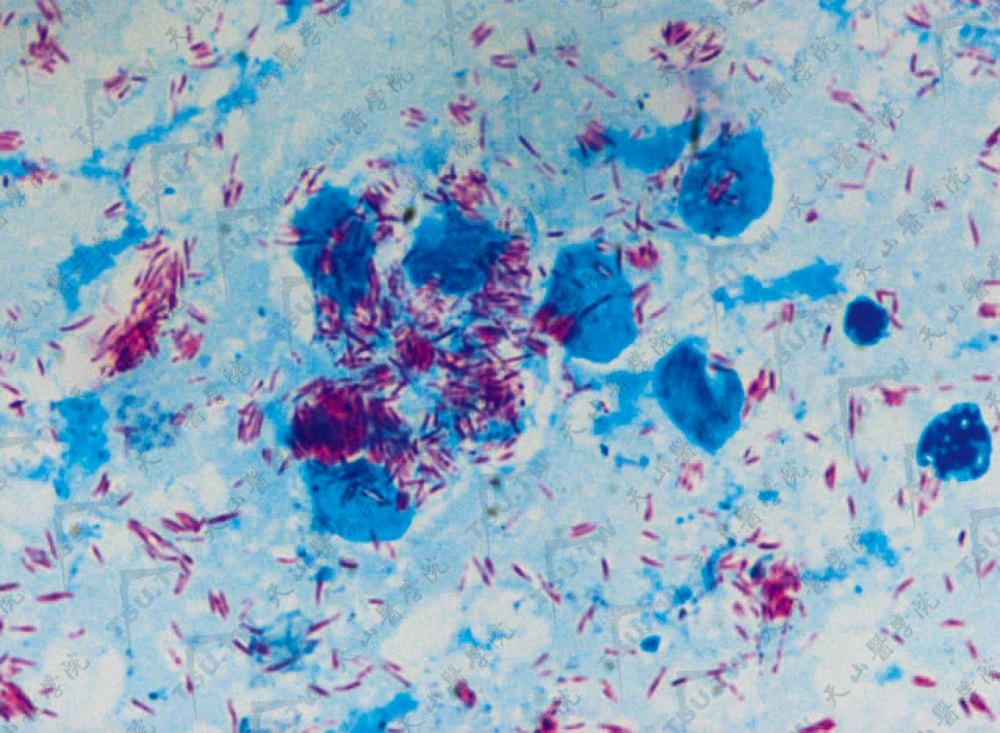
多菌型麻风皮肤涂片抗酸染色,麻风杆菌呈杆状、束状,可见菌球(油镜)(编写者提供)
二、麻风杆菌的一般特征
Shepard(1965年)的研究发现,在正常小鼠足垫中,对数生长期麻风杆菌的世代时间平均为13天,这可以解释麻风的慢性病程和较长的潜伏期。麻风杆菌在小鼠或犰狳模型中的致病力不会因供菌患者的性别、种族和地理分布的不同而有差异。麻风杆菌主要侵犯机体的表浅部位,提示其生长温度低于37℃。Shepard(1965年)证明,温度低于25℃和高于36℃时,麻风杆菌在鼠足垫中的繁殖明显减少,最适生长温度为32~35℃。
三、麻风杆菌在体外的活力
麻风杆菌离开人体后仍能存活一段时间。Davey等(1974年)在英国的研究发现鼻分泌物中的麻风杆菌在平均温度20.6℃、平均湿度43.7%的暗处自然干燥后,定期感染小鼠足垫,结果发现维持活力的时间平均为1.75天,个别可长达7天。据报道在南印度的气候条件(平均温度36.7℃,湿度77.6%)下,从鼻分泌物和皮肤活检取材的菌液在干燥和阴暗的环境下,其活力可达9天,长于在英国所测得的1.75天,上述结果的差异可能与印度和英国两地的气候条件不同有关。
四、物理因素对麻风杆菌活力的影响
实验证明,麻风菌悬液储存在-80℃保存10个月,菌活力无大变化;在-25℃,菌活力至少可保持6个月;在0℃时,菌活力可保持3~4周;含菌的组织或匀浆在4℃保存7~10天,其活力不变;在21℃时保存3天,活力略下降;在45℃时活力迅速丧失;在60℃时0.5~1小时,活力完全丧失;若煮沸1~8分钟活力受到影响,煮沸15分钟则活力丧失。106和107菌悬液用30W紫外线距1~2m处分别照射30~60分钟,麻风杆菌完全丧失活力;在温度为27~32℃,相对湿度为30%~37%的夏日,麻风杆菌经阳光直接光照1小时,菌活力明显降低,光照2小时菌活力完全丧失。一般认为麻风杆菌的抵抗力比结核杆菌弱,可参照结核杆菌的消毒方法进行消毒,如煮沸、高压蒸汽、苯酚、甲酚、漂白粉、福尔马林熏蒸、紫外线及日光照射等。
五、化学因素对麻风杆菌活力的影响
鼠足垫感染模型证实,在室温条件下,麻风杆菌以2%氢氧化钠处理20分钟或在37℃以0.25%胰蛋白酶磷酸盐缓冲盐水消化1小时,对其活力无影响。但将氢氧化钠处理时间延长至60分钟,或将胰蛋白酶磷酸盐浓度增至0.5%,则菌活力丧失。麻风杆菌可以储存在液氮中,10%(V/V)二甲基亚砜是最好的保护剂。在标本运送中,无论菌悬液还是含菌组织,在4℃能维持7天可使菌活力无明显丧失。
六、麻风杆菌的生物化学特性
- 有细胞壁和“荚膜”:细胞壁成分很复杂。其中一种重要成分是脂化阿拉伯甘露聚糖(lipoarabinomannan,LAM)。它有免疫调节功能,在发病和分枝杆菌细胞内成活方面发挥重要作用。麻风杆菌的荚膜可能是脂类物质。其一是结核菌蜡酯(PDIM),在化学结构上与结核菌及其他分枝杆菌的PDIM有所不同。第二种是酚糖脂-l(PGL-l)。PGL-1的末端糖残基是麻风杆菌所特有,具有抗原性,可以诱发特异性抗体产生。据认为麻风杆菌的脂质荚膜在感染期间有防止宿主巨噬细胞产生的溶酶体酶和反应性氧代谢物对其伤害的功能。
- 细胞质:发现三种主要蛋白质,即28kD、17kD、与GroES相关的热休克蛋白(HSP)。其他还发现有65kD、70kD、28kD、18kD等蛋白。
- 基因组:麻风杆菌基因组测序已于2001年公布。测序用麻风杆菌取自犰狳。麻风杆菌基因组为环状,含3.27Mb,具有1700个开放阅读框架。半数以下的基因组含有功能基因:存在许多假基因。麻风杆菌有165个特有基因,其中29个可归因于功能基因。限制性片段长度多态性(RFLP)分析提示麻风杆菌是一种单一种(Single species),但是目前基于麻风杆菌蛋白的氨基酸测序工作提示有细的种的差异,这可进行有关遗传的新的研究。
七、麻风杆菌的聚合酶链反应(PCR)
几种PCR探针(18kD、36kD、65kD)和核糖体的RNA序列已经开发用于检测取自麻风病人组织中的麻风杆菌DNA。虽然这些是特异的,但用以诊断皮肤涂片常规染色细菌为阴性的病人还不够敏感。
八、麻风杆菌耐药的PCR检测
鉴于检测麻风杆菌耐药的鼠足垫方法不仅费时,而且价格昂贵,且活检标本于接种前,在0~4℃保存不能超过5天,因此大多数实验室已不开展该方法。分子生物学方法已被用于麻风耐药的检测,简化了药敏试验。然而DNA分析是直接从临床标本中检测麻风杆菌的基因突变,实际上并非所有导致麻风杆菌耐药的突变现象均可被识别,在不同药物靶基因发现的各种突变也尚未全部被证实,因此麻风杆菌耐药的PCR检测尚待进行广泛深入的研究。
九、麻风杆菌的动物接种
由于麻风杆菌的体外培养(包括人工培养基培养和细胞培养)均未获得公认的成功。因此对麻风的研究多借助于动物接种。1960年美国学者Shepard将麻风杆菌接种于免疫正常小鼠的足垫中,获得局部的有限繁殖。1971年Kirchheimer等报道用麻风杆菌接种九带犰狳(生活在美洲的低等哺乳动物)后产生瘤型麻风严重播散性病变,且可侵犯神经。犰狳的麻风病变极为广泛,几乎遍布全身,包括中枢神经系统,同时有明显的麻风杆菌血症,表明是血源播散的结果。由于从感染犰狳的组织中能获取大量麻风杆菌,为制取麻风菌素(lepromin A)、麻风疹苗以及进行麻风杆菌生化、代谢和体外培养研究提供了充足的菌源。
1976年Kosaka等报道用裸鼠接种麻风杆菌,增菌现象明显。麻风杆菌能稳定地在裸鼠体内保存,易于反复传代、保留菌种,作为麻风实验研究的菌种来源。其主要缺点是动物要在SPF条件下饲养,所需费用较大。
灵长类动物实验麻风模型研究始于19世纪末和20世纪初,直到20世纪80年代才有了突破性进展。至今报道能感染麻风杆菌的灵长类动物有黑长尾猴、恒河猴、非洲绿猴、黑猩猩、短尾猴及树鼩等,均可产生类似瘤型或界线类麻风的播散性病变。灵长类动物实验麻风模型的应用,将有助于对麻风传染方式、免疫学和发病机制的研究以及作麻风疹苗模型的研究评价。
