1990年Anhalt首先提出本病的命名,是与潜在的淋巴增生性疾病密切相关的自身免疫性疾病,部分病例与使用氟达拉滨(抗肿瘤药)有关。临床特点为痛性口腔炎和多形性皮损。对治疗反应差,患者常死于合并症,包括肺受累所致的呼吸衰竭。
病因及发病机制
大约2/3病例,皮损出现前已发现良性或恶性肿瘤,另1/3患者皮损发生后肿瘤才被检测到。目前有四种学说解释副肿瘤性天疱疮的发生:
- 交叉反应学说:患者体内产生抗肿瘤抗原的抗体,该抗体与皮肤中的抗原交叉反应而致疾病。
- 细胞免疫学说:观察表明PNP患者的典型皮疹之一是扁平苔藓和多形红斑样皮损,这些苔藓样皮疹的病理学基础是真皮上部单一核细胞呈苔藓样浸润,表皮基底细胞液化变性,单个角质形成细胞坏死。提示细胞介导的免疫反应参与PNP病理生理过程。
- 表位扩散学说:表位扩散是初次免疫应答或炎性过程导致组织损伤,使一些“隐蔽”抗原暴露于免疫系统,从而激发继发性免疫应答。
- 细胞因子学说:部分Castleman瘤患者IL-6水平明显增高,而且IL-6显著升高患者呈渐进性的临床过程。切除肿瘤后,自身免疫及炎性反应恢复正常的过程与IL-6浓度变化平行。另一个参与PNP免疫反应的细胞因子是IFN-α,有人报道以IFN-α治疗肿瘤,患者全身皮肤黏膜发生皮疹并确诊为PNP,因而推测IFN-α可能与PNP发病有关。
症状表现
皮肤黏膜损害
大多数患者有难治性的口腔炎,表现为口腔内持续性水疱、大疱和糜烂,伴随整个病程,对治疗反应差。与寻常型天疱疮的口腔损害不同,本病的口腔损害更多的为坏死和扁平苔藓样变化。也可先出现在舌侧缘,逐渐发展,特征地累及唇红(下图)。有时口腔损害为本病的惟一临床表现。其他黏膜如口唇、齿龈、颊、舌、鼻咽、口咽、食管和生殖道黏膜亦可累及。
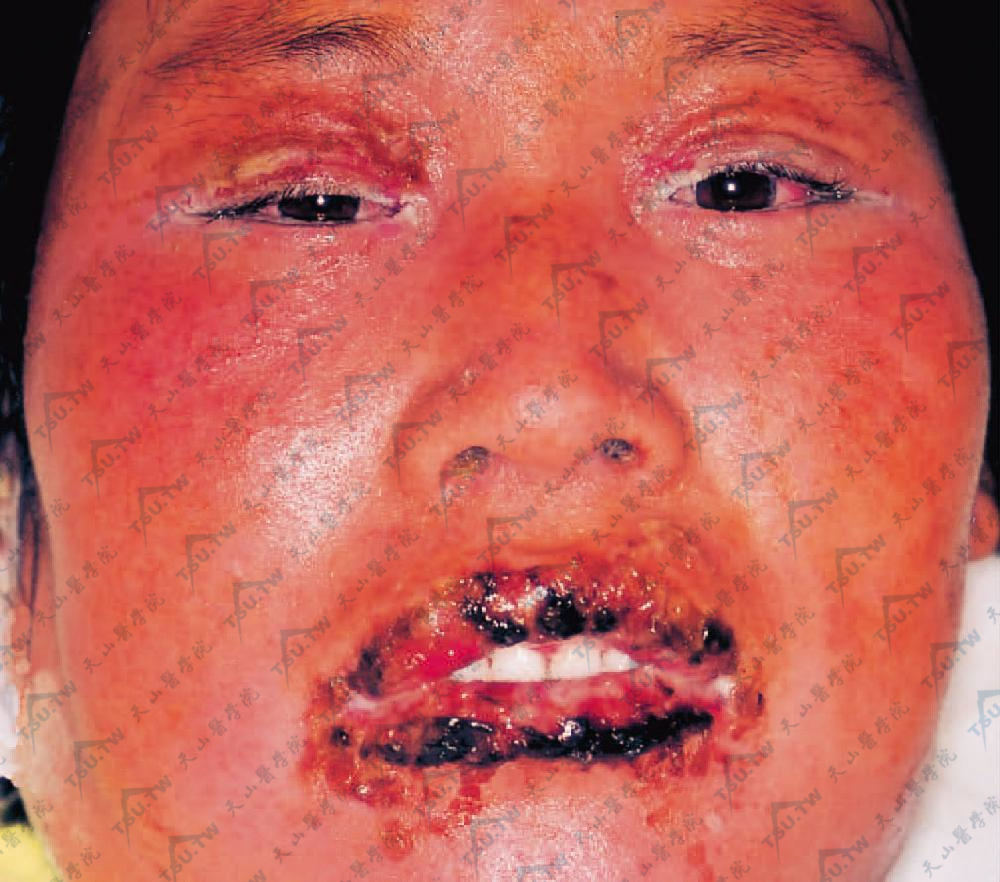
口唇、眼睑水肿、糜烂,球结合膜充血
皮损形态多样,不同个体差异较大,最初报道的患者,在躯干上部、头、颈和四肢近端反复出现水疱。水疱可以松弛易破,留下糜烂面(图3-13-13)。出现在四肢的水疱有时非常紧张,类似大疱性类天疱疮。部分水疱周围红斑,类似多形红斑。而躯干上部的皮损易出现糜烂、融合,类似中毒性表皮松解(TEN)。值得注意的是,多形红斑或中毒性表皮松解是自限性疾病,病程数周,而副肿瘤性天疱疮的皮损进行性发展,历经数月而不消退。
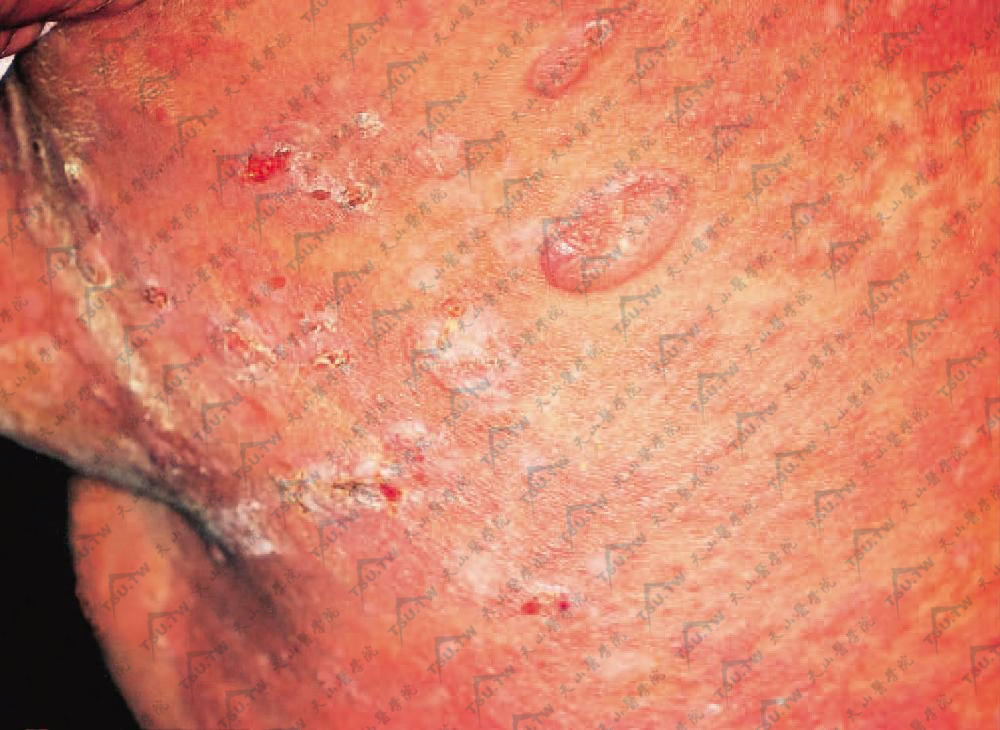
背部红斑、水疱及大疱
扁平苔藓样疹最常见,且可以是本病惟一的皮损,可在原先出现过水疱的部位出现。扁平苔藓样疹存在时,几乎总有严重的口腔炎出现。病情进入慢性期或治疗后,皮肤上扁平苔藓样疹比水疱更占优势。与寻常型天疱疮不同的是,副肿瘤性天疱疮的水疱和苔藓样疹常出现在掌跖(图3-13-14)和甲褶组织,而寻常型天疱疮很少有肢端和甲褶处皮损。
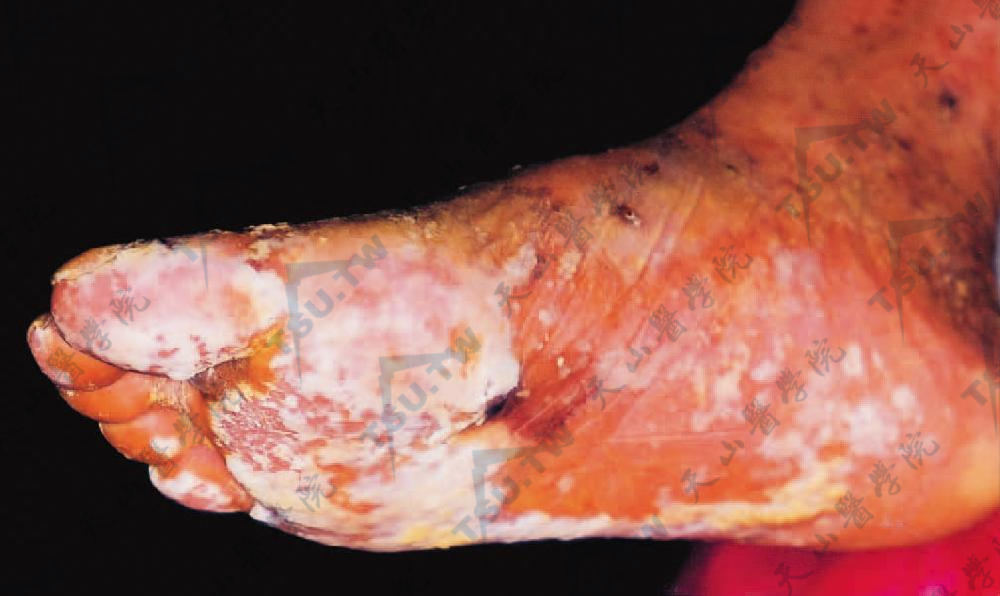
足跖部水肿性红斑、水疱及糜烂
系统受累
经典的天疱疮患者从未累及支气管和肺泡。但在PNP,肺部侵犯几乎发生于所有患者,且病情较重多为致死原因。尸检发现PNP患者气管、支气管、小气道细胞凋亡、坏死、堆积,导致闭塞性细支气管炎。有报道表明肺部侵犯发生于30%PNP患者,已经发现网蛋白基因家族的自身抗体可能导致呼吸道上皮棘层松解,导致闭塞性细支气管炎,由于细支气管和肺泡瘢痕形成,导致不可逆的致命性呼吸衰竭。除了表皮和其他上皮组织之外,神经系统也常因机体对潜在肿瘤的异常免疫反应而成为受累靶器官,结果导致机体衰弱或威胁生命。
伴发肿瘤
PNP多伴随潜在的良性或恶性肿瘤,大约2/3病例,皮肤疾病出现在已存在肿瘤的患者,另1/3病例皮损发生后肿瘤才被检测到。伴随PNP的各种肿瘤的发生频率依次为非霍奇金淋巴瘤、慢性淋巴细胞白血病、Castleman肿瘤、胸腺瘤(良、恶性)、低分化肉瘤、Waldenström巨球蛋白血症、炎症性纤维肉瘤、支气管源性鳞状细胞癌、圆形细胞脂肉瘤、霍奇金病和T细胞淋巴瘤(下图)。
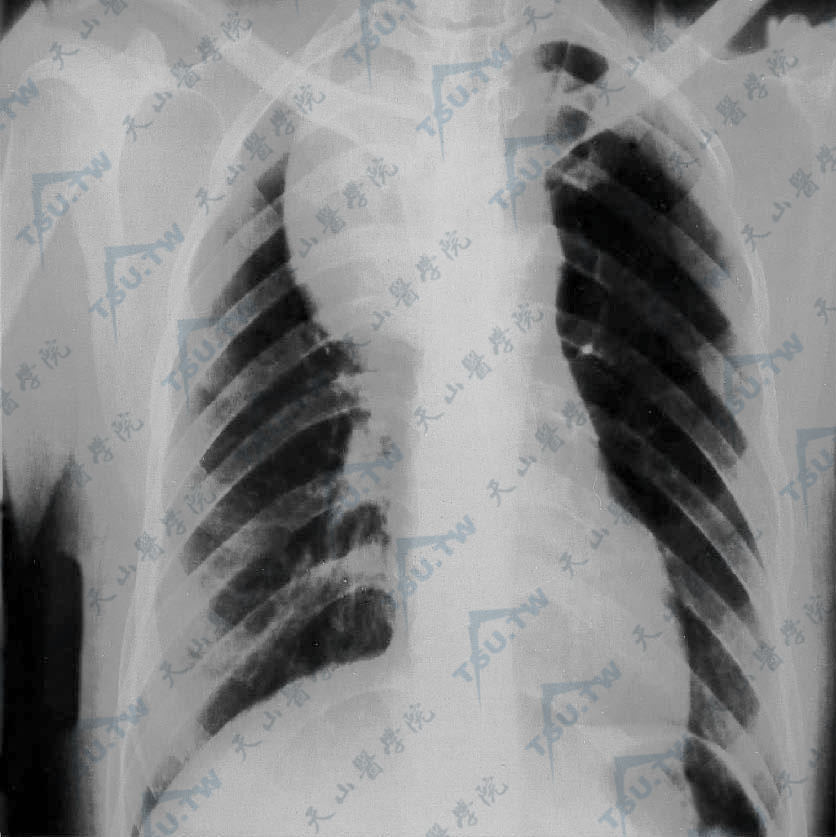
胸部Ⅹ线片显示,气管偏左,右上纵隔增宽,球形肿块突出于右上肺野,经CT检查示纵隔肿瘤
组织病理
口腔损害多为严重的黏膜炎,呈现炎症和溃疡的非特异性表现。皮损周围取材则为角化不良细胞,以及不同程度的基底层上棘层松解和散在坏死的角质形成细胞。
皮损形态不同,病理表现亦不同。非炎症性的皮肤水疱的病理变化以基底层上棘层松解为主,与寻常型天疱疮相似,但真皮乳头部无嗜中性粒细胞和嗜酸性粒细胞,以及表皮嗜酸性粒细胞海绵形成。皮损为红斑和丘疹的病理为基底细胞液化变性及真皮浅层较多致密淋巴细胞浸润构成的界面皮炎。苔藓样皮损可见真皮乳头部致密的淋巴细胞浸润,表皮内偶有个别淋巴细胞浸润和坏死。血管周围炎细胞浸润主要由单一核细胞组成,也可能为淋巴细胞。真皮上部无角化不良细胞,未见细胞异型性和血管炎。
直接免疫荧光检查:大多数受累上皮的细胞表面有IgG自身抗体,但检查常为假阴性,因此需反复取材。少部分病例在细胞表面和基底膜带有IgG和补体沉积。
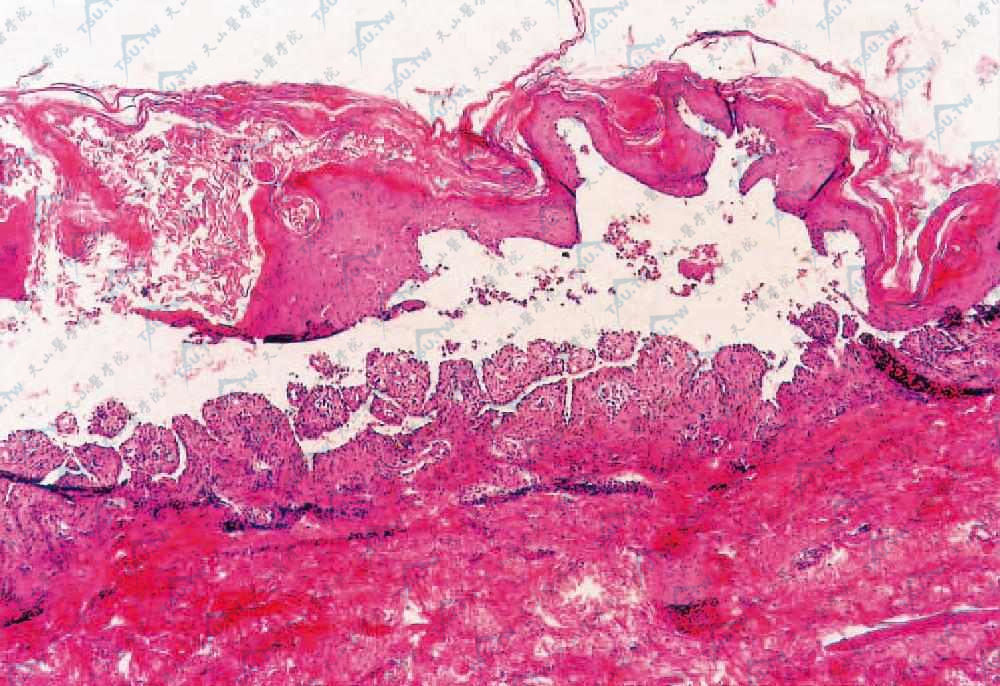
基底细胞层上表皮内水疱(HE染色×200)
间接免疫荧光检查:所有患者皆呈现鼠膀胱上皮棘细胞间荧光,表明患者血清中有IgG抗体存在。也可用其他鳞状上皮和移行上皮的切片为底物(如猴舌或食管)。
免疫印迹试验或免疫共沉淀:以表皮蛋白提取物为底物,患者血清可识别多种表皮棘细胞间连接蛋白,主要是斑素蛋白(plakin)系列。最常见的是壳斑蛋白(envoplakin)、周斑蛋白(periplakin),其次为桥粒斑蛋白Ⅰ(desmoplakin Ⅰ)和桥粒斑蛋白Ⅱ(desmoplakin Ⅱ),有的患者还可识别大疱性类天疱疮抗原1(BPAG1)以及一种相对分子质量为170 kD的不明蛋白分子。
诊断及鉴别
Anhalt等最早提出PNP诊断标准为:
- 痛性进行性口炎,首先累及舌部,皮损为多形性;
- 组织病理包括表皮棘层松解、角化不良细胞和空泡界面变化;
- IIF示角质形成细胞间IgG、C3沉积伴有或不伴有基底膜带沉积;
- IIF可查到血清有多种上皮细胞的自身抗体;
- 免疫沉淀示独特的4种多肽复合物250、230、210、190 kD。
Joly等提出至少满足下列7项中的4项也可诊断:
- 伴随肿瘤;
- 伴随寻常型天疱疮、多形红斑(和)或大疱性类天疱疮的临床症状和体征;
- 组织病理示基底层上棘层松解、角质形成细胞坏死和(或)空泡界面皮炎;
- 皮损DIF示IgG和(或)C3在角质形成细胞间和基底膜带沉积;
- IIF示血清中存在能结合在正常人皮肤角质形成细胞间和基底膜带的循环抗体;
- IIF:病人血清中有抗鼠膀胱上皮细胞的自身抗体;
- 免疫印迹测定可检测到下列一条或多条带,分子量为250、230、210、190 kD。
我国朱学骏提出以下6条诊断标准:
- 皮肤上有水疱、大疱性损害,皮疹具有多形性;
- 眼、口腔、外阴部黏膜广泛糜烂,渗出物较多;
- 伴有扁平苔藓样的紫红色斑丘疹,尤其是双手掌、足跖大片紫红色斑;
- 组织病理示基底层上棘层松解,表皮内角质形成细胞坏死,基底细胞液化变性,真皮浅层致密的炎细胞浸润;
- 直接免疫荧光示棘细胞间荧光,间接免疫荧光示患者血清中有抗棘细胞间物质抗体:
- 发现相伴的良性或恶性肿瘤。
治疗
对伴有良性肿瘤或包裹性肿瘤的PNP患者,如胸腺瘤或Castleman肿瘤,可采取手术切除,肿瘤切除后,绝大多数患者皮损改善或完全清除,皮损完全消退约在肿瘤切除后的6~18个月。这期间需要持续用免疫抑制剂。国外文献报道常规治疗为口服泼尼松0.5mg/kg、环孢素5mg/kg和环磷酰胺2mg/kg,症状好转后逐渐减量。伴发闭塞性细支气管炎的病例,病情进展快,易出现不可逆的呼吸衰竭,且对各种药物抵抗,即使未检测到恶性肿瘤,也以死亡告终。
对于伴发恶性肿瘤者,目前无公认的有效治疗方案。皮损对治疗反应较快,但口炎对多数治疗方案抵抗。糖皮质激素只能使皮损部分缓解。其他治疗方案如免疫抑制剂、环孢素、金制剂、氨苯砜、血浆置换、光分离置换(photopheresis),均未取得明显疗效。伴发非霍奇金淋巴瘤或慢性淋巴细胞白血病的PNP患者多在诊断后1~2年死亡。死因多为继发败血症、消化道出血、多器官衰竭或呼吸衰竭。
