血管炎的病因尚未完全清楚。可能的病因包括:
- 感染:如慢性扁桃体炎、鼻窦炎、中耳炎、根尖肉芽肿、胆囊炎、支气管炎、泌尿生殖系统感染、前列腺炎、颈部淋巴结炎等。这些病灶内的细菌使机体致敏。亦有报道真菌感染为血管炎的致病原因之一。肝炎病毒、流感病毒、单纯疱疹病毒和人免疫缺陷病毒等也与本病的发生可能有关。
- 药物、化学物质、食物等。
- 伴有系统性疾病:如结缔组织病、恶性肿瘤、异常蛋白血症等。
- 自身血管组织抗原而引起的一种自身免疫反应。
血管炎的发病机制比较复杂,大致可有免疫性和非免疫性发病机制,以免疫性占绝大多数。皮肤血管炎的免疫性机制主要为:
免疫复合物的沉积
血管炎的发生与免疫复合物沉积于血管壁有明显的关系,大多数血管炎是由此机制引起的。尤其是小血管的血管炎。
引起人类疾病的免疫复合物分子量超过50万。组成复合物的抗原可以是微生物的某些蛋白成分、药物、变性免疫球蛋白、病毒等。这些抗原的量轻度超过相对应的抗体量则形成可溶性免疫复合物,较易沉积于血管壁基膜,特别是肾和皮肤的血管。
当免疫复合物在某些特定条件下沉积于血管壁基膜时,复合物中抗体重链的Fc部分被“活化”从而吸引循环淋巴细胞,产生细胞毒因子而损伤血管壁;但大部分是使补体系统活化产生一系列的变化。补体的活化可通过传统途径,亦可通过替代途径(如过敏性紫癜的IgA免疫复合物可激活替代途径,使复合物成为可溶性)。其活化物可产生下列作用:
- 免疫黏附,即复合物通过活化的C3b结合于中性粒细胞的特殊受体上;
- 产生过敏毒素(C3a和C5a)作用于肥大细胞及嗜碱性粒细胞使之释放组胺等化学介质,导致内皮细胞的收缩,增强血管壁通透性,免疫复合物易沉积于血管壁,增加内皮细胞的选择素的表达;前炎症性细胞因子的释放(如IL-1,TNF-α),诱导内皮细胞中的黏附分子的表达(P-选择素和E-选择素);产生趋化因子,趋化及激活中性粒细胞;
- 由于C3b的作用而增强了中性粒细胞吞噬复合物的作用。
上述一系列反应使中性粒细胞的溶酶体释放多种溶酶体酶,如蛋白酶、胶原酶、弹力蛋白酶并产生活性氧(ROS)及血管通透性因子等,破坏血管基膜和其他结构,形成血管壁不同程度的坏死以至血栓形成。免疫复合物又可引起血小板聚集,释放血管活性胺类,亦可直接吸引未致敏的淋巴细胞,并释放细胞毒因子而引起血管的损伤。
中性粒细胞能在24~48小时内降解沉积的免疫复合物,通常在24小时内,所以直接免疫荧光检查血管炎性皮损,如时间超过3~12小时常会得出阴性结果。
由于免疫复合物沉积的血管部位、大小、数目以及免疫复合物的物理化学特性的不同,则产生血管炎的不同临床表现。轻型的血管炎不一定表现有出血或坏死,而仅为红斑与水肿,在组织学上也不一定见到中性粒细胞的浸润。
影响免疫复合物沉积的因素很多,例如:
1.流体静压:流体静压高的部位较流体静压低的部位易于沉积。如皮肤血管炎好发于下肢及衣服收紧的部位。
2.血管通透性:Cochrane等曾报道免疫复合物沉积局限于血管壁时,很大程度上由于血管活性胺的释放引起血管通透性的增加。故Ⅰ型变态反应可能对Ⅲ型变态反应起一定的作用。
3.免疫复合物的组成及浓度:这可能是影响复合物沉积于组织实际部位的主要因素。动物实验证明,由于抗原、抗体结合时比例不同,复合物可溶性的程度不同,可引起不同的病理过程。当抗原量多于抗体时,则形成可溶性抗原抗体复合物,易引起系统性变化。反之,如抗体量过多则形成不溶性的免疫复合物,易沉积于局部,引起局部炎症。复合物中抗原、抗体呈等价带时,则引起过敏性肉芽肿病变。亦有报道复合物的浓度不同,引起的组织损伤亦不同。
4.机体吞噬细胞的功能:正常情况下单核吞噬细胞系统几乎能够清除与分解所有潜在损害的免疫复合物,使免疫复合物从血管内膜移去而不滞留。但在某些特定条件下,免疫复合物沉积于某些组织内且与血液中的吞噬细胞隔开而发生疾病。另一方面,也可能由于循环免疫复合物的不断存在及其他未知的机体因素,引起单核吞噬细胞系统的部分封闭,而使单核吞噬细胞系统的功能降低。
抗中性粒细胞质抗体
抗中性粒细胞质抗体(antineutrophil cytoplasmic antibody,ANCA)是第一个被证实与血管炎相关的自身抗体,是一类以中性粒细胞和单核细胞胞质成分为靶抗原的自身抗体。ANCA可针对中性粒细胞质颗粒中的多种抗原成分,如蛋白水解酶3(proteinase3,PR3,为一种29 kDa的中性丝氨酸蛋白酶)、髓过氧化物酶(myeloperoxidase,MPO)、杀菌通透性增加蛋白(bactericidal permeability increasing protein,BPI)、弹力蛋白酶、组织蛋白酶G(Cath G)、乳铁蛋白、溶菌酶、明胶酶等。其中PR3和MPO是两个主要的靶抗原。感染可能是产生某些ANCA的激发因素。
ANCA谱根据以中性粒细胞为底物,间接免疫荧光有3种不同的荧光形态:
- 胞质型:即c-ANCA(cytoplasmic staining-ANCA),细胞质示颗粒性染色,在分叶核间染色更强,主要靶抗原为PR3(PR3-ANCA);
- 核周型:即p-ANCA(perinuclear staining-ANCA),核周染色,主要靶抗原为MPO(MPO-ANCA);
- 非典型型:即a-ANCA(atypical ANCA)。
ANCA的致病机制是多方面的。
- ANCA在用TNF-α预处理后,能活化中性粒细胞,中性粒细胞脱颗粒,产生活性氧、一氧化氮(nitric oxide)和细胞因子;
- ANCA活化中性粒细胞,后者上调黏附分子,黏附到TNF活化的内皮细胞上;
- ANCA也能促使内皮细胞表达黏附分子,产生IL-6、IL-8,从而趋化中性粒细胞,引起中性粒细胞脱颗粒,刺激单核细胞产生活性氧和IL-8;
- ANCA可使中性粒细胞表达MAC-1增多。
ANCA致血管炎的主要机制可能是作用于中性粒细胞,然后导致内皮细胞的损伤。
ANCA的临床意义:ANCA是原发性系统性血管炎的重要的血清学标志,具有诊断价值,可作为监测疾病活动性及预后的指标,阳性者疾病较重,治疗后持续阳性说明可能治疗失败,也可能容易复发。1990年美国风湿病学会颁布了ANCA相关性血管炎的标准分类,主要包括Wegener肉芽肿病、显微镜下多血管炎及变应性肉芽肿病。已知抗PR3-ANCA与Wegener肉芽肿病相关,抗MPO-ANCA与显微镜下多血管炎相关。
在用间接免疫荧光法筛查到ANCA阳性时,可用ELISA方法证实针对MPO或PR3的ANCA抗体。
ANCA除见于系统性血管炎外,也可见于一些其他疾病。ANCA免疫荧光型与中性粒细胞的胞质成分及相关血管炎的关系详见下表。
ANCA与中性粒细胞的颗粒成分及相关血管炎的关系
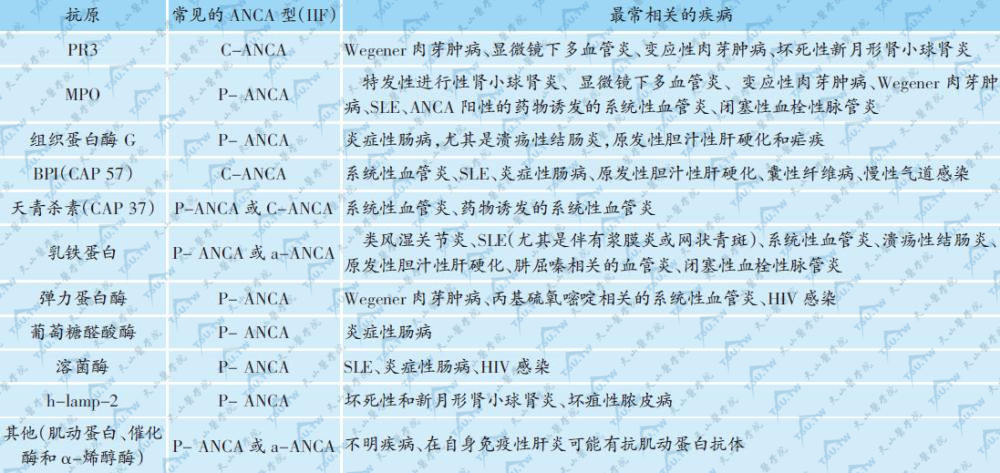
注:h-lamp-2:人溶酶体相关膜蛋白2,human lysomsome-associated membrane protein-2
(摘自Rook's Text Book of Dermatology第7版)
抗心磷脂抗体、超抗原
抗心磷脂抗体:是微血管血栓形成的重要因素。此抗体结合于血管内皮细胞,有很多的作用。能活化单核细胞,刺激细胞因子和血管黏附因子的表达,致易形成血栓。在自身免疫状态下,其结合需要血浆β2-糖蛋白-I(β2-GP-I)的存在,后者本身结合于血管内皮细胞与磷脂形成复合物。
超抗原:在形成血管炎的机制中也可能有超抗原的参与,如川崎病,但这个理论仍有争议。
抗内皮细胞抗体和其他的因子
抗内皮细胞抗体(antiendothelial cell antibodies,AECA)在血管炎的发病机制中的重要性还不能肯定。多数Takayasu动脉炎或闭塞性血栓性脉管炎活动期有高滴度抗内皮细胞抗体;而在Wegener肉芽肿病、显微镜下多血管炎、川崎病、白塞病和伴有血管炎的系统性红斑狼疮患者中,其阳性率不一致;其他的一些结缔组织病、溶血性尿毒症综合征、血栓形成性血小板减少性紫癜、IgA肾病、溃疡性结肠炎和糖尿病患者此抗体也可阳性。有临床研究观察中等或大血管性血管炎中该抗体的滴度与疾病活动有相关性,但这是否能说明是该抗体的致病机制,还是说明血管损伤的程度,尚不清楚。但抗内皮细胞抗体主要结合于肠系膜血管的内皮细胞,这点可支持抗内皮细胞抗体可能参与内脏小动脉炎的发病。
AECA可通过补体或不经补体介导的抗体依赖的细胞毒作用引起血管内皮细胞的损伤;也可通过核因子KB激活内皮细胞,使内皮细胞增加黏附分子如细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)和E-选择素等的产生;也可增强中性粒细胞的细胞毒作用。E-选择素表达于被细胞因子活化的内皮细胞上,是内皮细胞活化、白细胞与内皮细胞相互作用的促进剂,可能在血管炎的发病中起了积极的作用。系统性血管炎中,E选择素的水平与疾病的活动性并无相关性。
与细胞免疫的关系
血管炎的发生除体液免疫因素外,与细胞免疫亦可能有一定的关系。这一型的免疫反应是在坏死性血管炎周围有淋巴细胞的浸润,如结节性红斑,虽偶见血管壁的坏死,但主要是淋巴细胞的浸润,可能与特殊的细菌与真菌等病原菌的Ⅳ型变态反应有关。Unanue等报道变应性肉芽肿病可能属于第Ⅳ型变态反应。因此伴坏死性血管炎的肉芽肿的发生机制可能是迟发型超敏反应,它能独特地引起肉芽肿病,并继发地形成免疫复合物(也有人认为由于患者免疫反应性差异,所产生的免疫复合物类型、特性、数量不同而引起肉芽肿反应)。
在血管损伤的部位均有CD4+和CD8+细胞浸润。在Wegener肉芽肿病中,Th1细胞因子占优势。但也有研究发现在鼻黏膜为Th2优势,这可能可以解释Wegener肉芽肿病的复发与鼻部葡萄球菌感染有关。
IgE与血管炎的发生
由IgE介导的速发型变态反应与血管炎的关系,在上述免疫复合物引起的机制中已经提及。直接由于IgE速发型而造成的血管炎,其病理学表现主要为血管周围的嗜酸性粒细胞浸润。例如变应性肉芽肿病在临床上同时合并有哮喘、枯草热及嗜酸性粒细胞增多,在组织学上为明显的嗜酸性粒细胞浸润性肉芽肿,血清中IgE增高。
血管炎的发生除免疫学机制外,还与纤维蛋白溶酶活力、血液的黏稠度、血管壁的通透性、淤血、重力或外部压力,以及局部血管构造和分叉等因素有关。这些因素可加重或诱发血管炎的发生。如高血压引起的血管炎,是由于血液动力学改变所致。巨球蛋白血症引起的血管炎,则是由于血液黏稠度增加而引起。还有遗传性因素参与,某些血管炎偶可有家族性发病的现象,如Wegener肉芽肿病。α1-抗胰蛋白酶(α1AT)为天然的PR3和弹力蛋白酶的抑制剂。α1AT的缺陷可以是遗传性,也可以是获得性。获得性是由于抗PR3-ANCA引起α1AT-PR3复合物。已有α1AT-缺陷PiZZ表型和ANCA阳性的血管炎间有相关性的报道。在ANCA阳性的系统性血管炎中,PiZ杂合现象与预后差有关系。另有一大样本血清研究显示PiZZ缺陷与弹力蛋白酶有相关性,认为α1AT-缺陷还不足以引起ANCA相关的血管炎。在1例α1AT-缺陷慢性血管炎病人用α1蛋白酶抑制治疗获得极好的疗效。
皮肤血管炎的病种很多,现根据本章分类中所列举的疾病分述如下,其中硬红斑及结核性结节性静脉炎仍按通常习惯于本篇第三章杆菌感染性皮肤病第二节皮肤结核中叙述。属于淋巴细胞性血管周围炎,如急性痘疮样苔藓样糠疹在本篇第十九章丘疹鳞屑性皮肤病中叙述。游走性血栓性静脉炎在本篇第十六章皮肤脉管性疾病内叙述。至于其他系统性疾病伴发的血管炎的皮肤表现,常相似于下述疾病中某些皮肤症状,故在临床诊断下述疾病时,要注意排除其他系统性疾病。
