坏疽性脓皮病是一种少见的非感染性嗜中性皮病,皮肤有复发性疼痛性坏死性溃疡,常伴有潜在的系统疾病。本病可发生于不同年龄,以40~60岁最常见,少见于儿童。女性略多于男性。
病因及发病机制
病因尚未完全明确,因本病约50%合并有相关的系统疾病,其中大多为自身免疫性疾病,故认为本病可能也是一种免疫性疾病。认为体液免疫和细胞免疫异常均与该病的发生有关。本病也见于因伴随疾病、感染(如HIV感染)或治疗等引起的免疫抑制患者。
体液免疫:报道的体液免疫的异常包括有针对皮肤及肠组织的自身抗体。患者血清中有皮肤坏死因子,当将这种因子注入患者自己的皮肤后可发生皮肤坏死。在该病患者血清中还有一种血清因子,当给豚鼠注射后可发生坏疽性脓皮病样的皮损。约半数患者血清免疫球蛋白不正常。多数γ球蛋白增高。在坏疽性脓皮病溃疡活动性病损边缘取材作直接免疫荧光检查,有相当一部分病例的真皮乳头层和网状层毛细血管后静脉血管壁有IgM、C3和纤维蛋白沉积。还有研究认为坏疽性脓皮病的机制与Arthus和Schwartzman反应一致,皮肤外伤常为本病的重要诱因之一,有人认为可能是一种Schwartzman反应。该反应是由于循环免疫复合物沉积于血管壁,导致补体的经典和旁路途径激活。
细胞免疫缺陷:包括皮肤对念珠菌、腮腺炎病毒抗原、链激酶、纯化的蛋白质衍生物(结核菌素)、链道酶及二硝基氯苯(DNCB)的无反应性,植物血凝素(PHA)抗原皮试和PHA淋巴细胞转化试验阴性,淋巴细胞产生巨噬细胞抑制因子减少。
此外,中性粒细胞趋化性降低,单核细胞吞噬功能的异常。这些白细胞的异常可能是引起针刺反应的机制,该反应可发生于半数的坏疽性脓皮病。
临床症状
临床症状多样,初起可为炎性丘疹、水疱、脓疱或小结节。很快中心坏死,形成大小不等的疼痛性溃疡,损害不断扩大且向深层发展,境界清楚,边缘皮肤呈紫红色,水肿。溃疡周围可出现卫星状排列的紫色丘疹,发生破溃后又与中心部溃疡融合。溃疡底可溢脓,覆有坏死组织及肉芽组织。溃疡中心可不断愈合,形成菲薄的萎缩性筛状瘢痕,同时又不断向四周远心性扩大,形成大的向周边伸展的崩蚀性溃疡(下图)。皮损可单发或多发,散在或丛集,好发于下肢、臀部或躯干,其他部位亦可受累,如上肢、面、颈、阴囊、女阴、颊黏膜、舌及外耳道等。此外,溃疡可发生在创伤的部位,尤其是注射部位。
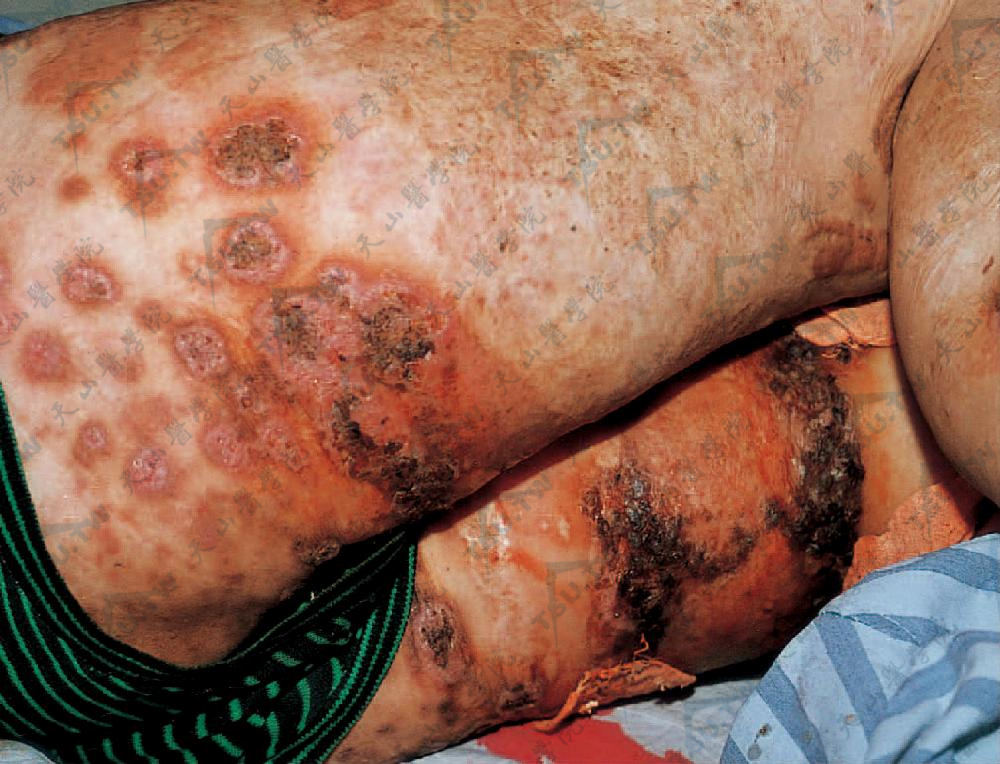
下肢紫红色斑,中央坏死形成溃疡
皮损一般都有较剧烈的疼痛和压痛。有时疼痛可为皮损发生的前兆,预示病情即将加重。而疼痛消失又可先于其他症状的改善,表明治疗开始奏效。病程经过可急可缓。急剧者皮肤溃疡在数日内迅速扩大。轻缓者溃疡经数周至数月逐渐发展。
本病伴有的系统症状包括发热、不适、肌痛等。可伴有皮肤外的其他症状,约半数患者伴有相关的疾病,最常见的是炎症性肠病。1/3以上坏疽性脓皮病患者伴有轻重不一的关节症状,从关节疼痛至进行性畸形性关节炎。
本病儿童发病少,约1/4儿童坏疽性脓皮病无潜在疾病。皮损发生于外生殖器、头、面部和颈部的并不少见。
本病可复发,间隔时间不定,从数月至数十年。碘化钾摄入可使病情加重,有的病例碘化钾斑贴试验阳性。
四种亚型的临床表现
溃疡型 经典型,有溃疡及潜行性边缘。可从周围绕有红晕的炎性脓疱或结节发展而来,也可继发于损伤引起的同形反应处(针刺同形反应)。数天后变大,开始形成溃疡。常开始于下肢或躯干,但也可发生于任何部位,常合并的疾病包括炎症性肠病、关节炎和单克隆免疫球蛋白病。
脓疱型 该型常发生于炎症性肠病的急性加重期,常在炎症性肠病控制后消失。也可与增殖性脓性口腔炎、角层下脓疱性皮病和IgA丙种球蛋白病合并存在。发生于正常皮肤上的散在疼痛性脓疱,周围绕以红晕,发生于四肢伸侧,可发展为典型的溃疡型。
大疱型或“不典型”型 常为迅速发生的浅表性出血性大疱,破坏性较经典型小,病变较浅,疼痛也较轻。常位于上肢。具有急性发热性嗜中性皮病的临床及组织病理学表现,为炎症性斑块,可发生表皮的浅表糜烂。但其特征是能发生溃疡,愈后留有瘢痕。常伴有的潜在疾病为白血病或真性红细胞增多、骨髓增生性疾病。
增殖型或浅表肉芽肿型 非疼痛性浅表性筛状溃疡,溃疡底部清洁,常无紫色潜行性边缘。常为位于躯干的单发性损害,缓慢进展,损害隆起,有肉芽肿性边缘,经一般治疗可以消退,常不伴有任何潜在的系统疾病。
组织病理
该病的组织病理因皮损的类型、位置、疹龄及治疗等不同而有不同的表现,且无特异性,但对排除其他的可能病因有帮助。典型表现包括损害中央表皮和真皮的坏死和溃疡,紧接着溃疡周围为密集的急性炎细胞浸润,其外有混合的炎细胞及慢性炎细胞浸润。每种临床亚型有其相应的表现。
溃疡型有真表皮大量的中性粒细胞浸润,伴中性粒细胞脓肿的形成;脓疱型有毛囊周围中性粒细胞浸润,伴角层下脓疱形成;大疱型有中性粒细胞浸润,伴有表皮内水疱形成;增殖型伴有周围栅栏状组织细胞和巨细胞的肉芽肿性反应。
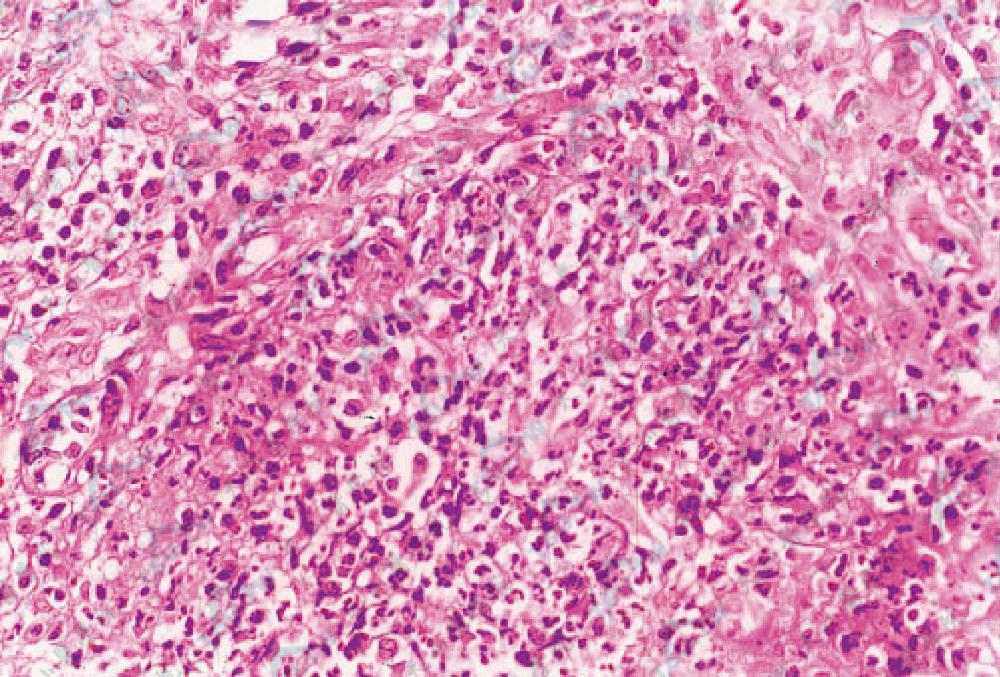
真皮中多种炎细胞弥漫性浸润,其中多见中性粒细胞核碎裂(HE染色×400)
关于该病伴有血管损害的观点仍有争议。很多研究者报道了有中性粒细胞血管反应(白细胞碎裂性血管炎)、肉芽肿性血管炎和淋巴细胞性血管炎的表现,但还未被所有的研究证实。
诊断及鉴别
坏疽性脓皮病因实验室检查和组织病理学表现无特异性,诊断为排除性诊断。根据炎性丘疹、脓疱、潜行性溃疡,有剧烈疼痛,特定的发病部位,年龄及全身症状等临床特点,可以诊断。但必须与其他疾病进行鉴别。
感染性溃疡 皮损活检组织进行针对细菌和真菌等病原体的特殊染色和培养,对排除细菌、分枝杆菌、真菌病应有帮助。应做梅毒血清学试验和抗心磷脂抗体的检测,因为梅毒肉芽肿性溃疡和抗磷脂抗体综合征可与溃疡型或增殖型坏疽性脓皮病症状相似。
急性发热性嗜中性皮病 鉴别比较容易,因为急性发热性嗜中性皮病不发生溃疡,发生突然,愈后无瘢痕。
有血管炎表现的一些综合征 如Wegener肉芽肿病、白塞病和SLE常与坏疽性脓皮病混淆,但坏疽性脓皮病无白细胞碎裂性血管炎的特征。
治疗
应根据疾病的严重程度、分型及相伴随的原发性疾病进行治疗。积极治疗原发潜在疾病,如脓疱性损害,治疗潜在的炎症性肠病可获得改善。增殖型对治疗反应好。系统用抗生素有助于控制皮损的继发性细菌感染。在疾病的进行期和用糖皮质激素未快速控制症状时,应加用免疫抑制剂。虽然以前用硫唑嘌呤、环磷酰胺、苯丁酸氮芥治疗有效,现在倾向于选用环孢素。
一、系统治疗
1.糖皮质激素 适用于病情较重的急性病例或局部外用治疗效果不好的病例。泼尼松40~80mg/d[≥1mg/(kg·d)],症状控制后,可迅速减量。如果用常规剂量无效或其他药物无法控制时,可试用甲基泼尼松龙冲击疗法。
2.免疫抑制剂 免疫抑制剂可联合糖皮质激素治疗,或糖皮质激素无效时单独使用,或帮助减少糖皮质激素用量。这些药物有严重的副作用,如骨髓抑制,所以限用于严重的或顽固性病例。如硫唑嘌呤、环磷酰胺、苯丁酸氮芥、苯丙氨酸氮芥等。硫唑嘌呤是最早使用的。甲氨蝶呤对于有关节炎或炎症性肠病的病例有效。
近来也有用环孢素的报道,通常剂量小于5mg/(kg·d)有效,起效所需时间需1~3周。约85%用环孢素治疗病例获很好的疗效,包括对糖皮质激素、其他治疗方法及免疫抑制剂无效的病例。如果治疗效果不好,剂量可加至10mg/(kg·d)。对进展极快的病例,开始即应考虑用环孢素,以达到控制病情的目的。酶酚酸酯疗效与环孢素类似。也有用他克莫司治疗有效的报道。氯法齐明100mg,每日3~4次,口服,部分病例有效,主要用于顽固病例,疗程不宜过长,要注意其不良反应。
3.氨苯砜 口服,每日150~200mg。尤适于慢性病例。单用有时也有效,机制可能是其抗炎作用或改变中性粒细胞的功能有关。
4.其他 有报道磺胺吡啶、柳氮磺胺吡啶单用或与糖皮质激素合用均有效。柳氮磺胺吡啶1.0~4.0g,每日4次,仅用于伴有活动性肠病的患者。机制可能是其抗炎作用或改变中性粒细胞的功能有关。Hecker等报道用沙利度胺治疗坏疽性脓皮病,每日100mg,6个月后皮损痊愈,未有复发。个案报道咪诺环素治疗有效,其治疗机制可能是其抗炎作用或改变中性粒细胞的功能有关。有用TNF-α抑制剂如英夫利昔单抗(infliximab)、依那西普(etanercept)治疗有效的报道。少数病例报道,用血浆置换、静脉注射丙种球蛋白治疗有效。也有用高压氧治疗成功的病例,能很快止痛。
二、局部治疗
对早期或轻型损害,可选用局部治疗,通常先用生理盐水湿敷后外涂抗菌制剂或用软膏剂或亲水剂敷料封包。亦有用2%色甘酸钠溶液湿敷,效果亦佳。糖皮质激素外用效果差,局部封闭治疗有较好的疗效,在溃疡局部边缘注射曲安西龙偶见显效。个别病例在清除病灶坏死组织后,或在局部切取活检组织标本后,皮损明显好转。最近报道早期病变外用他克莫司有较满意的疗效。
三、外科治疗
外科清创手术因为可能由于针刺反应而加重坏疽性脓皮病而有争议。但如果在长期用免疫抑制剂的过程中,针刺反应最小的情况下,可进行吸引疱皮肤移植和培养的自体角质形成细胞移植。
通常在损害完全消退后,即可终止治疗。可有复发。
