腺样囊性癌(adenoid cystic carcinoma,ACC)是以腺上皮、肌上皮细胞双相分化、具有管状、腺样和实性结构为特点的、病程缓慢但长期预后不佳的唾液腺恶性肿瘤。
早在1853年,Robin和Laboulbene就注意到了腺样囊性癌的特征性表现。1859年Billroth首先提出圆柱瘤(cylindroma)的名称。1945年,Bauer和Fox称其为腺肌上皮瘤(adenomyoepithelioma),Dockerty和Mayo曾用圆柱瘤型腺癌的名称。Ewing于1919年首先在唾液腺肿瘤中使用腺样囊性癌(carcinoma adenoides cysticum)的命名。目前的诊断名称由Foote和Frazell于1954年首先应用。腺样囊性癌为唾液腺较常见的恶性肿瘤,其发病率居唾液腺癌的第二位。根据国内6所医学院校统计,23 010例唾液腺上皮性肿瘤中,有2377例,约占10%,在9478例恶性唾液腺肿瘤中约占25%。多数人认为来自唾液腺闰管的储备细胞,程珺等(1985)通过超微结构及组织化学研究认为来源于闰管、排泄管的基底细胞或口腔黏膜的基底细胞。
临床表现
腺样囊性癌可发生于任何年龄(1~90岁),多见于中年或中年以上,小唾液腺发病比大唾液腺多。较大样本的统计显示,该肿瘤的性别分布差别不是很大,女性稍多见。最常见的部位是腮腺,以后依次为腭腺、下颌下腺、舌和口底、唇、颊、舌下腺、磨牙后区、牙龈。组织学上相似的肿瘤也见于鼻窦和鼻咽部、扁桃体和咽部、喉、气管和支气管、泪腺、外耳、皮肤、食管、乳腺、肺、肝、前列腺、子宫颈、卵巢、女性外阴和阴道、前庭大腺和颅内蝶鞍上区。极少数可发生于下颌骨中央,系由颌骨异位腺体发生。大多数病例统计报道在小唾液腺肿瘤中腺样囊性癌是仅次于黏液表皮样癌、第二位最常见的恶性肿瘤,而个别报道中腺样囊性癌在小唾液腺恶性肿瘤中最常见。舌下腺肿瘤的发病率虽然较低,一旦发生肿瘤首先应考虑为腺样囊性癌。
肿瘤生长缓慢,病期较长,呈圆形或结节状,较硬。此瘤在组织间浸润,因此临床上可见的肿物往往较小,但实际上肿瘤累及的范围很广。腭部肿物表面覆盖黏膜,表现血管扩张,可发生溃疡或腭骨穿孔。疼痛和麻木感是患者常见的症状,有的患者未发现肿块之前,首先出现疼痛等神经症状。肿瘤侵犯部位不同可引起相应的不同症状,舌部肿瘤可引起舌运动障碍,腮腺肿瘤可出现面瘫,下颌下腺肿瘤常侵犯舌神经和舌下神经,出现舌麻木及舌下神经麻痹等症状。舌下腺腺样囊性癌可因肿瘤生长引发导管囊肿,也可导致同侧下颌下腺导管阻塞。表现为下颌下腺区反复肿胀。肿瘤侵犯下颌骨的骨膜后,可沿骨膜生长,使对侧下颌骨发生破坏。唾液腺造影可显示为导管中断及碘油外溢等恶性肿瘤表现;也可显示导管移位,占位性病变等良性肿瘤表现。肿瘤侵犯颌骨时X线片可有三种表现:①骨组织无任何变化,颌骨切片见骨髓腔内充满肿瘤组织,但骨小梁无改变;②溶骨性破坏;③颌骨膨胀,呈多囊性破坏,牙根吸收。偶尔有肿瘤发生颅内侵犯,在临床和影像学上类似于脑膜瘤。个别病例呈隐匿性生长,初期难以发现。还有的病例有特殊的临床表现如海绵窦综合征、进展性三叉神经麻痹、首发症状为转移性病变等。
颌骨中枢性腺样囊性癌可类似于牙根尖病变,临床上可临床伴疼痛,有牙髓治疗史,牙髓治疗后疼痛加重、进行性下颌膨胀。因X线见根尖区阴影,根充不全和根分叉累及而进行根尖切除术也有报道。
腺样囊性癌可以是多原发性肿瘤的类型之一。
大体病理
肉眼见肿瘤呈圆形或结节状,平均直径约3cm,剖面为灰白色,多为实性,其间有多少不等的白色条纹间隔。肿瘤无包膜,常侵犯周围组织。肿瘤有时表现为不明显的瘢痕样病变。小的肿瘤可有较清楚的界限,罕见情况下有部分包膜(图7-131)。肿瘤有沿神经扩展倾向。远离主肿瘤部位相当远的距离可见跳跃式病变。罕见情况下肿瘤为隐匿性沿小叶间隔浸润而无明显的肿块。
组织病理
腺样囊性癌的构成细胞有导管细胞即腔面细胞和非腔面肌上皮细胞。肿瘤细胞大小一致,形态较温和,有椭圆形嗜碱性深染的细胞核,染色质分布均匀,类似于皮肤的基底细胞癌。胞质很少,双嗜性或透明(图7-132)。肿瘤性肌上皮细胞的细胞核常常是有角的,少见情况下有较粗糙的染色质和明显的小核仁,多见于实性型、高级别者。偶尔高级别的细胞学表现也可见于中级别腺样囊性癌。导管细胞或腔面细胞呈立方状、卵圆形,大小较一致,胞质少,核呈圆形或卵圆形,着色较深,核分裂像少见。肌上皮细胞占肿瘤的大部分,扁平状或不规则形,排列在腔面细胞周围(图7-133)。上述两种细胞可排列成多种组织结构,WHO将腺样囊性癌分为管状型、筛状(腺样)型和实性型。筛状型最常见,实性型最少见。
一、管状型(高分化或Ⅰ级):肿瘤细胞排列呈小管状或索条状和腺样结构为主。小管由2~3列细胞形成,衬覆导管或腺样结构的为小的立方状细胞,偶尔为柱状上皮细胞,其外围绕以非腔面肌上皮细胞(图7-134、7-135)。管腔内有粉染黏液,PAS染色呈强阳性。索条周围常为大量玻璃样变性的间充质。
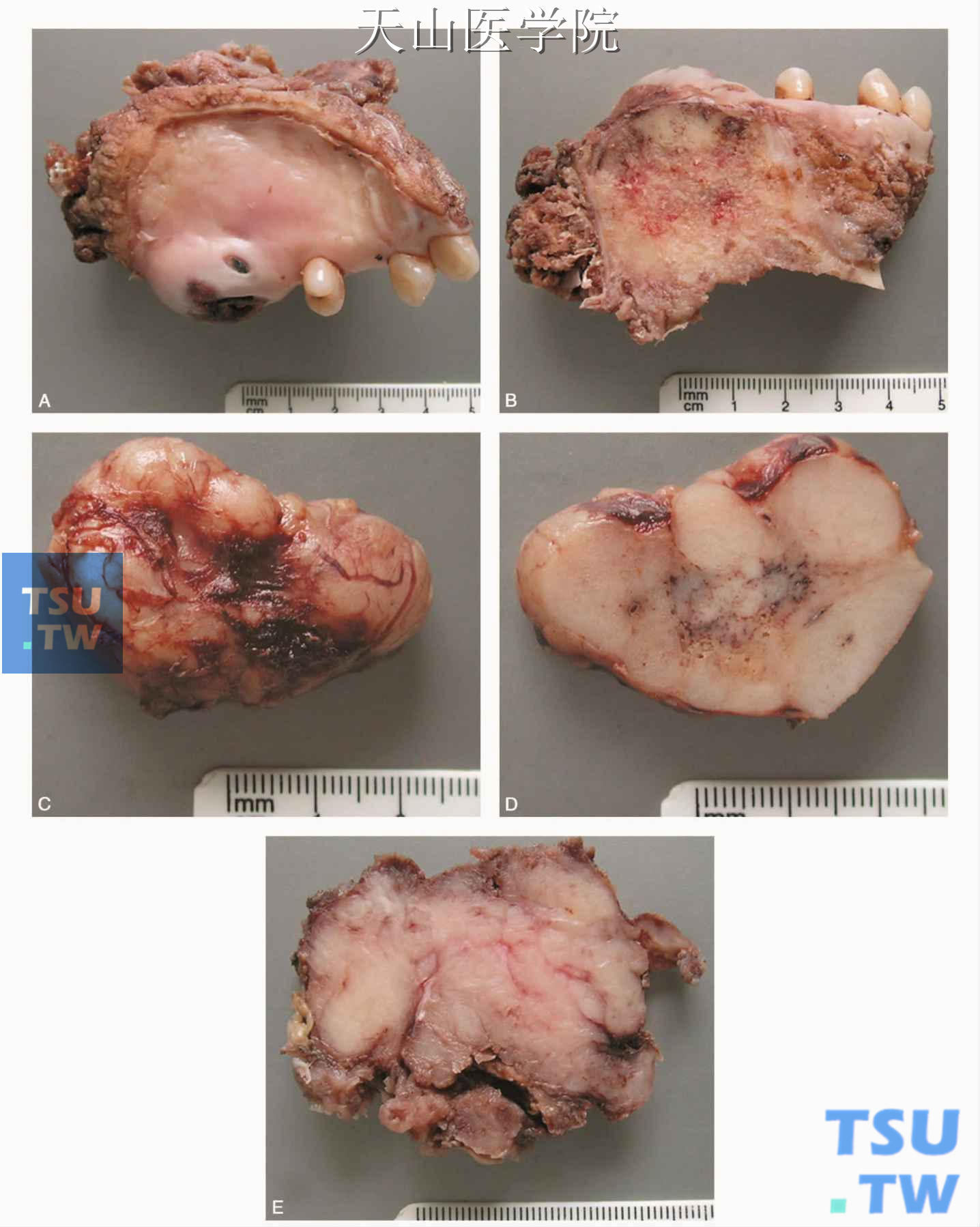
图7-131 腺样囊性癌的大体观 A、B为同一例,C、D为同一例(罗海燕分切、摄影)
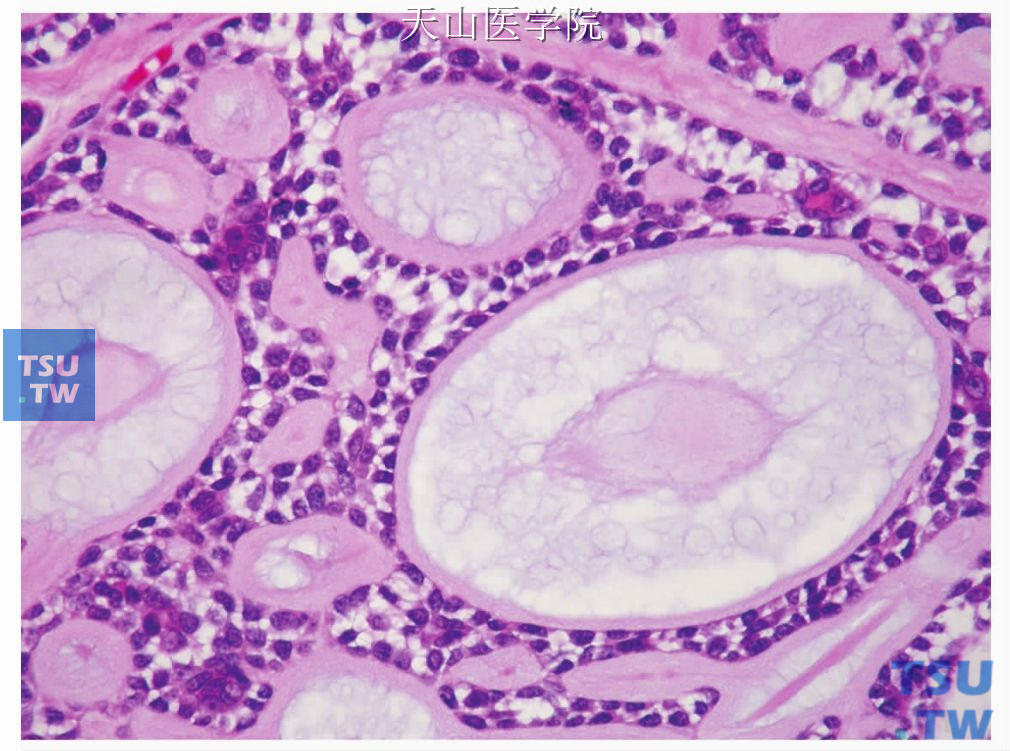
图7-132 腺样囊性癌:肿瘤细胞大小一致,大部分为肌上皮细胞,胞质少而透明
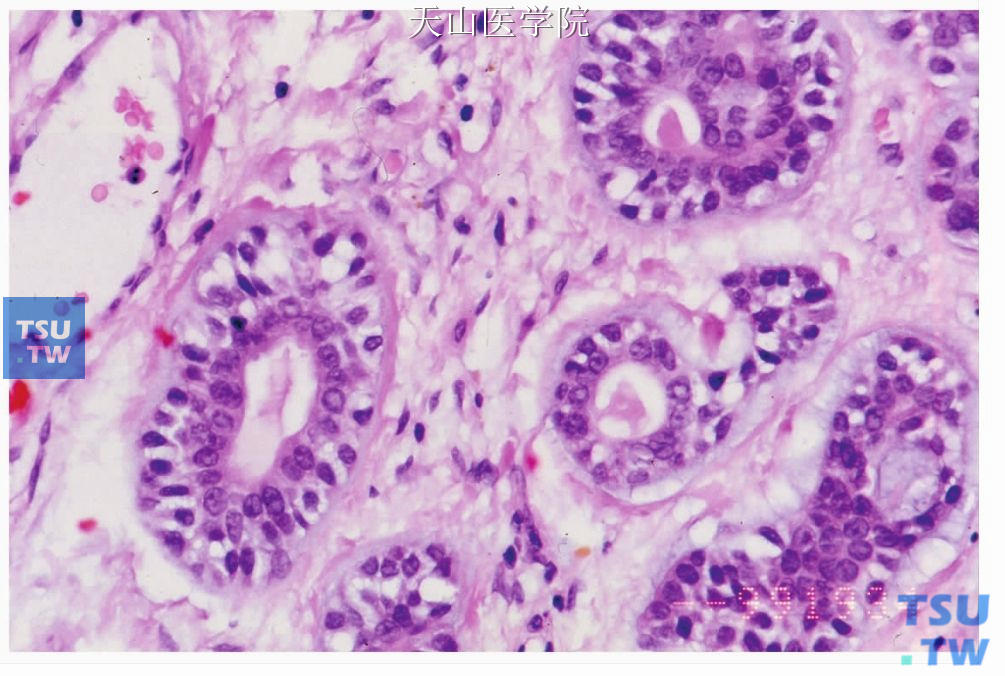
图7-133 腺样囊性癌:肿瘤性肌上皮细胞排列在腔面细胞外围
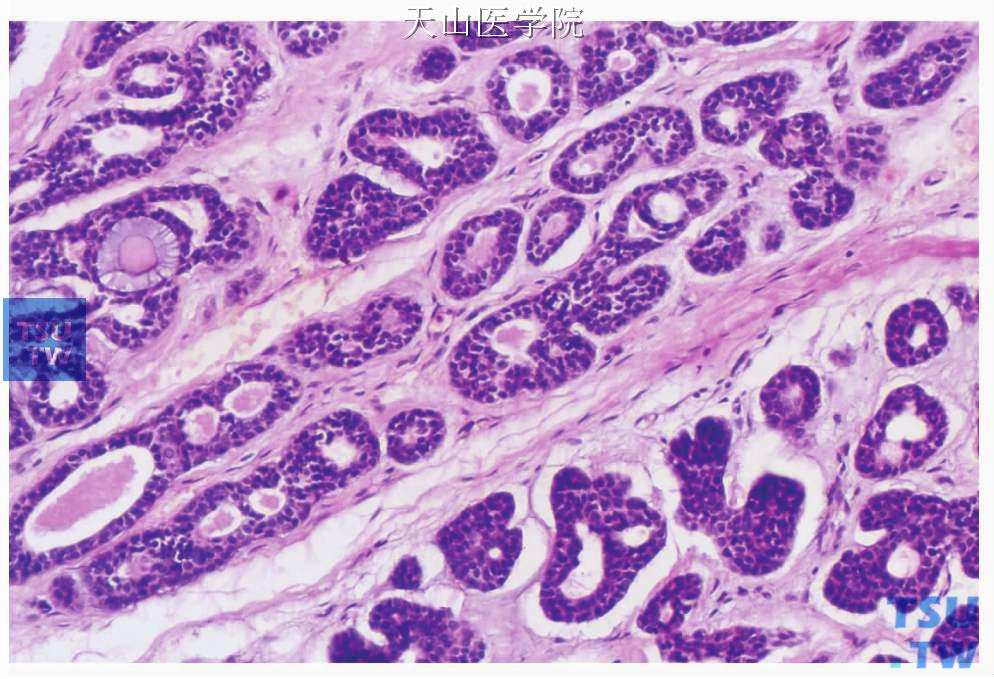
图7-134 腺样囊性癌:管状型,肿瘤细胞形成管状结构
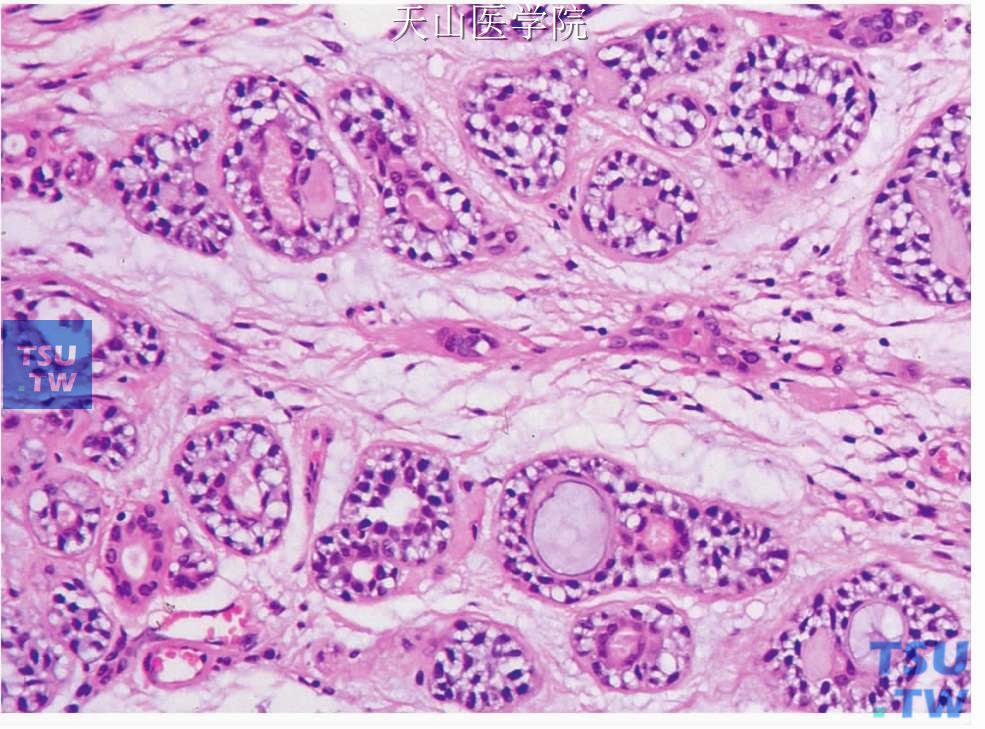
图7-135 腺样囊性癌
管状型,导管内层为小的立方、胞质嗜酸的导管细胞,外有肌上皮细胞围绕
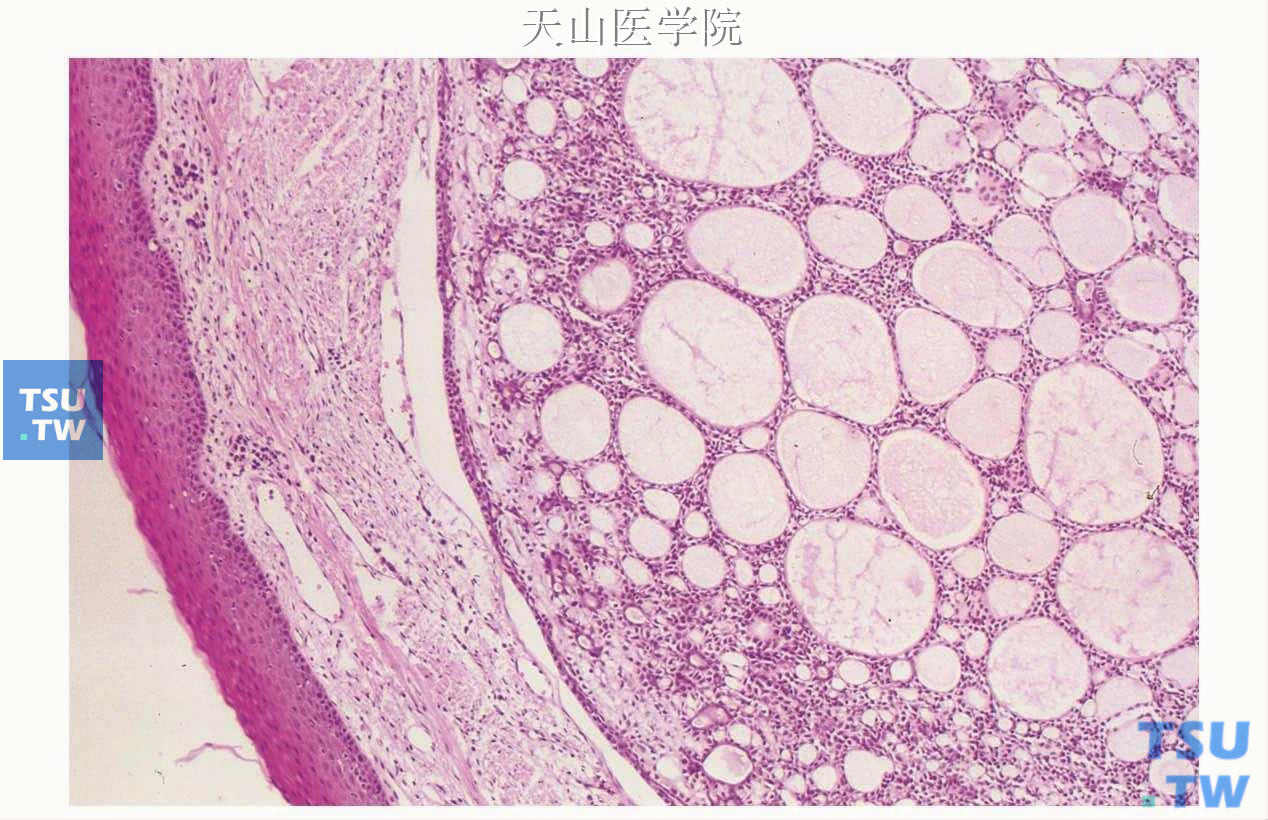
图7-136 腺样囊性癌:筛状型,肿瘤细胞形成筛状结构
二、筛状型(腺样型,中分化或Ⅱ级):是腺样囊性癌最具特征的结构。有人统计该型占腺样囊性癌的44%,管状型占35%。细胞排列成大小不等的侵袭性团块,其间有许多排列成“瑞士奶酪”样或筛孔状的囊样腔隙(图7-136),与藕的断面相似,称为假囊肿或假腺腔(pseudocysts or pseudolumina),假腺腔的边缘清楚(锐利),与周围的细胞分界明显,含有致密的粉红色基底膜物质形成的外壳,中央为蓝色的形成网状的糖氨聚糖物质或者完全被基底膜物质充满(图7-132)。这些不是真正的腺腔,没有微绒毛和细胞顶端的连接复合体,而是腺样囊性癌肿瘤细胞的产物,包括Ⅳ型胶原、层粘连蛋白、硫酸软骨素和纤维连接蛋白。囊腔内的嗜碱性糖氨聚糖为Alcin蓝阳性,嗜酸性基底膜物质为PAS、Ⅳ型胶原阳性。孔隙中的物质常发生玻璃样变性,有时很明显。围成假腺腔的细胞为肌上皮细胞。真正的腺腔即管状结构分散在假囊肿之间,外围绕以肌上皮细胞。这些真腺腔较假囊肿小得多,由类似于闰管的小立方细胞构成(图7-137)。
三、实性型(低分化或Ⅲ级):占腺样囊性癌的21%。肿瘤细胞大片状排列,主要是肌上皮细胞,内含不多见的导管样孔隙,内衬明确的腺上皮细胞层(图7-138)。偶尔含筛状型中的假囊肿。有时见单个细胞坏死或有粉刺样坏死。肿瘤细胞形成的实性团中常有较多的核分裂(图7-139)。此型细胞核可增大,染色质稀疏,有核仁出现,呈泡状核(图7-140)。胞质少,嗜碱性。虽然多数人认为实性型主要由肌上皮细胞构成,但这些细胞发生了一些变化,如c-Kit在筛状型和管状型中只在腔面细胞阳性,而在实性型中c-Kit弥漫阳性,实性区的微囊衬复细胞CK7、8、14、和19阳性也与筛状型中的不同,这些特点提示肿瘤细胞的异质性消失,细胞向腔面细胞方向分化。因此有人提出实性型的强侵袭性与肌上皮细胞的抑癌功能丧失有关。
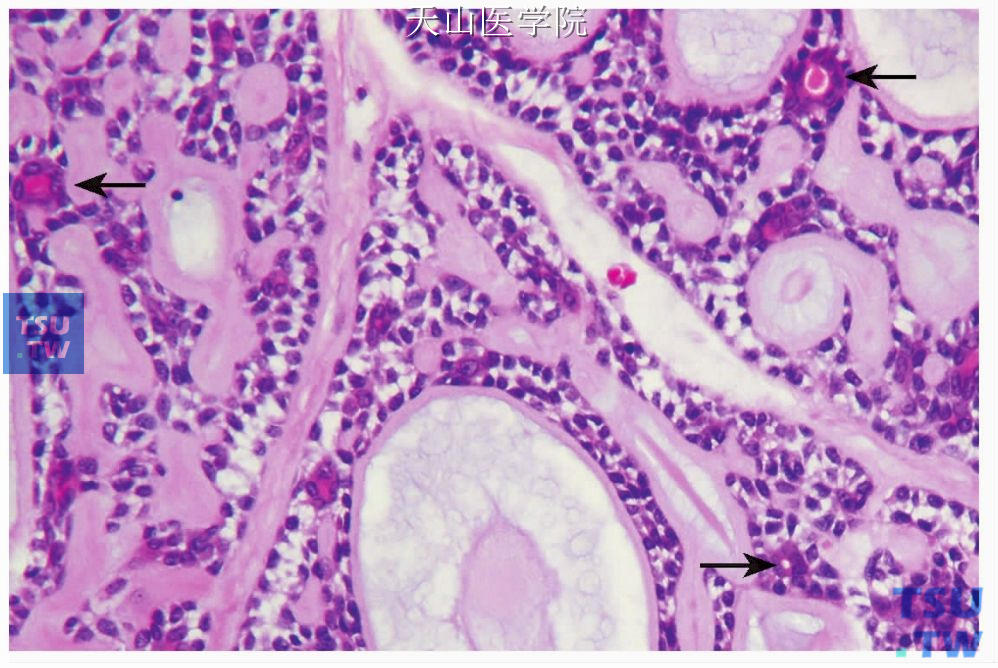
图7-137 腺样囊性癌
筛状型,筛状结构中导管样结构由类似于闰管的小立方细胞构成(箭头)
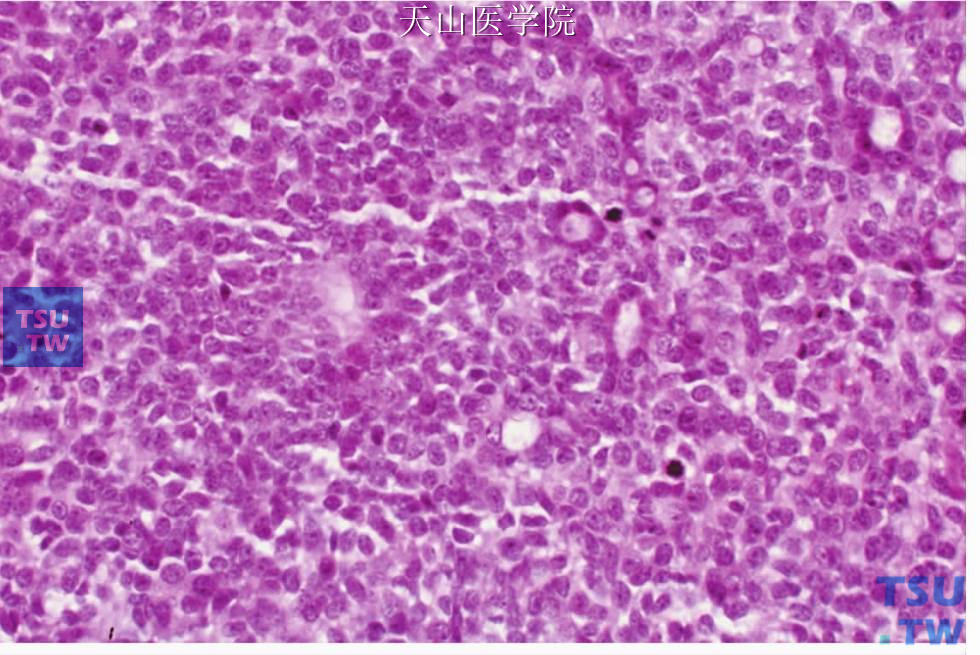
图7-138 腺样囊性癌:实性型,片状肿瘤细胞中可见导管样结构(右上方)
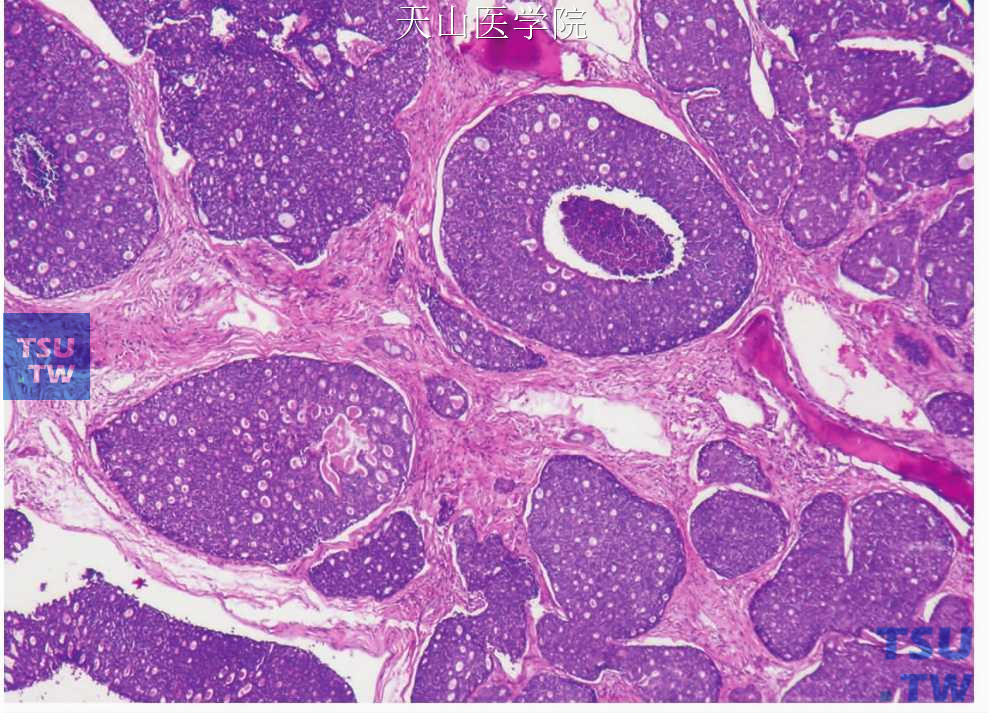
图7-139 腺样囊性癌:实性型,肿瘤实性团中央坏死
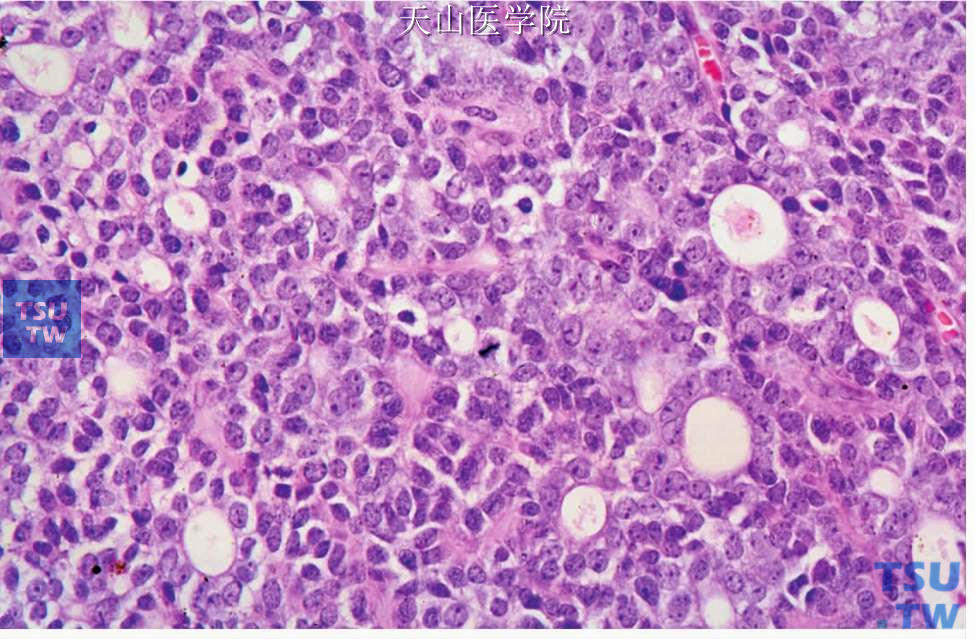
图7-140 腺样囊性癌:实性型,肿瘤细胞含小核仁,核分裂常见
在同一肿瘤中常出现两种以上的排列方式,但可以分出以某一类型为主。但是如果肿瘤中的实性部分超过30%时即应为实性型,因实性生长具有较强的侵袭性行为。同时,肿瘤细胞的排列方式多种多样,除上述的主要结构类型外,还可见多种以肌上皮细胞为主排列变异(图7-141~图7-143)。
腺样囊性癌的侵袭性较强,常围绕或侵犯神经和血管,而不伴随间充质反应。神经周扩展在各型中均常见(图7-144~图7-147)。
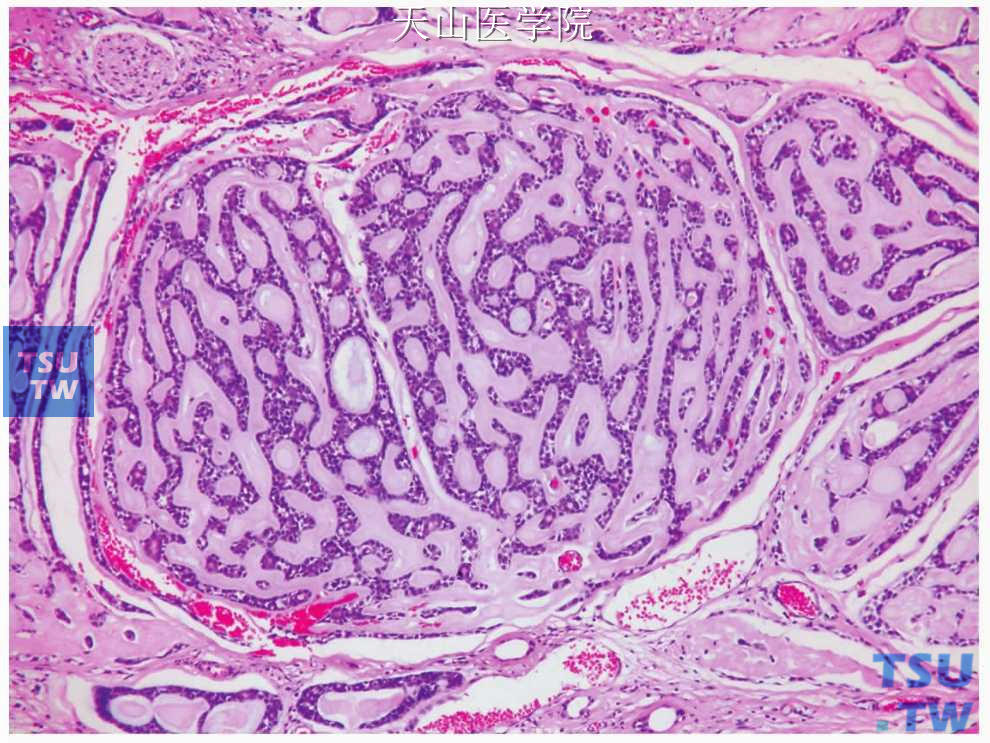
图7-141 腺样囊性癌:肿瘤细胞形成吻合的条索
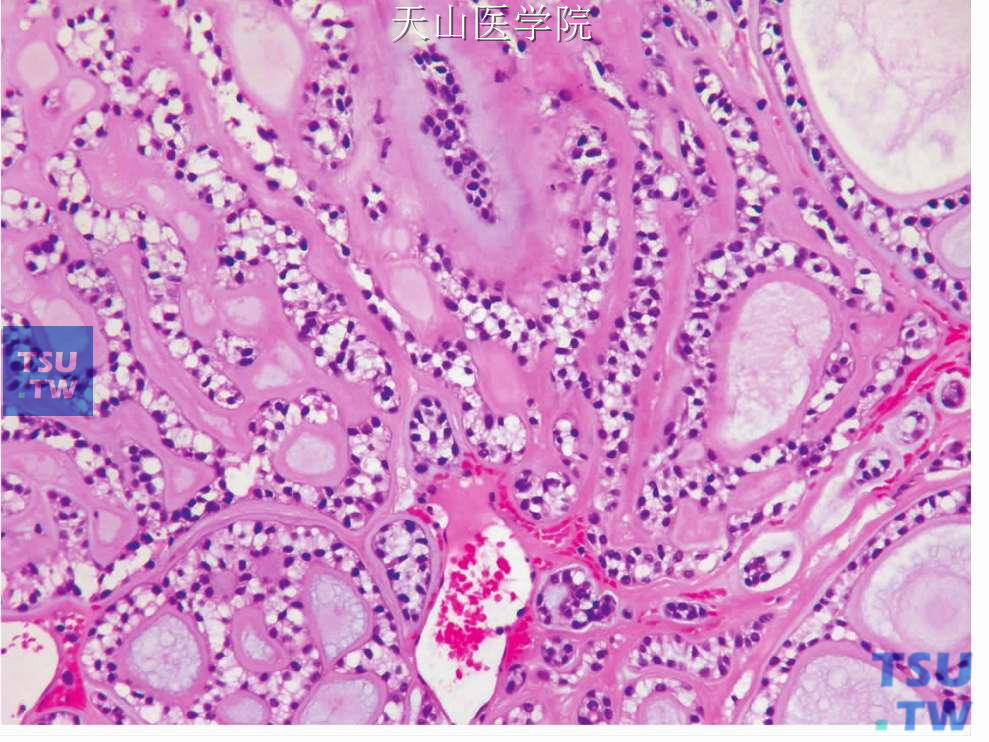
图7-142 腺样囊性癌:透明肌上皮细胞形成较多的细胞外基质
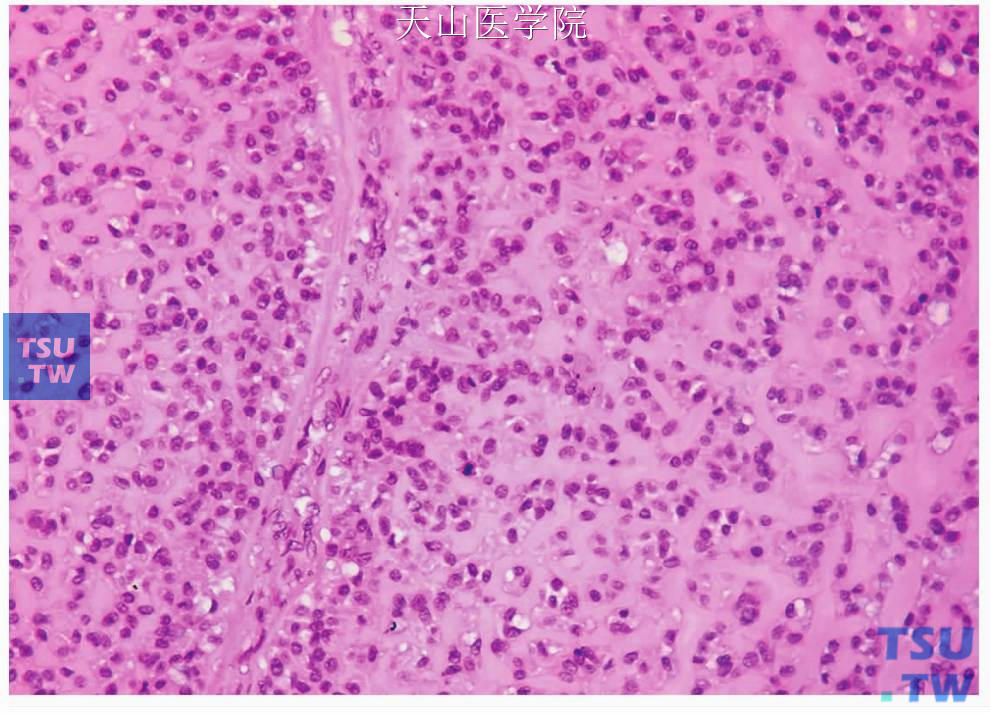
图7-143 腺样囊性癌:散在的肌上皮细胞及丰富的细胞外基质
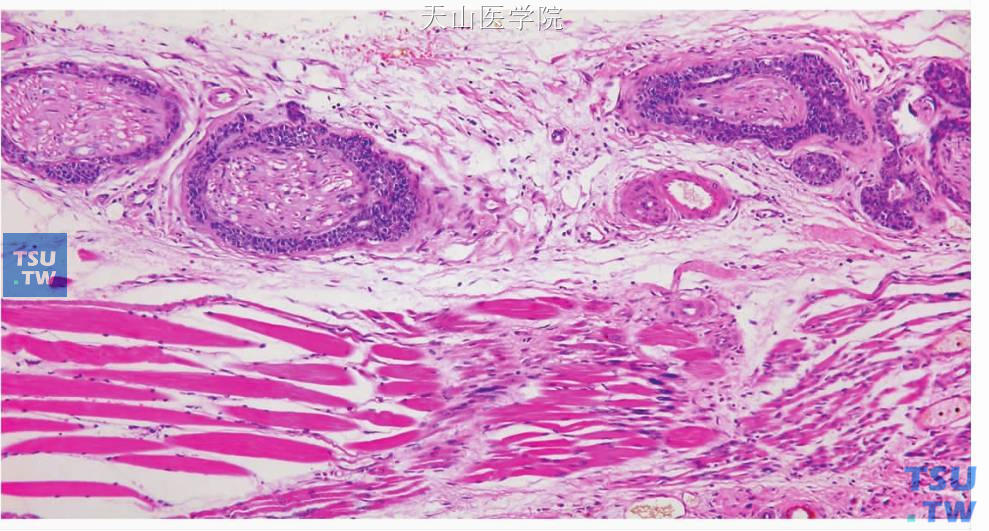
图7-144 腺样囊性癌:肿瘤细胞沿神经束生长
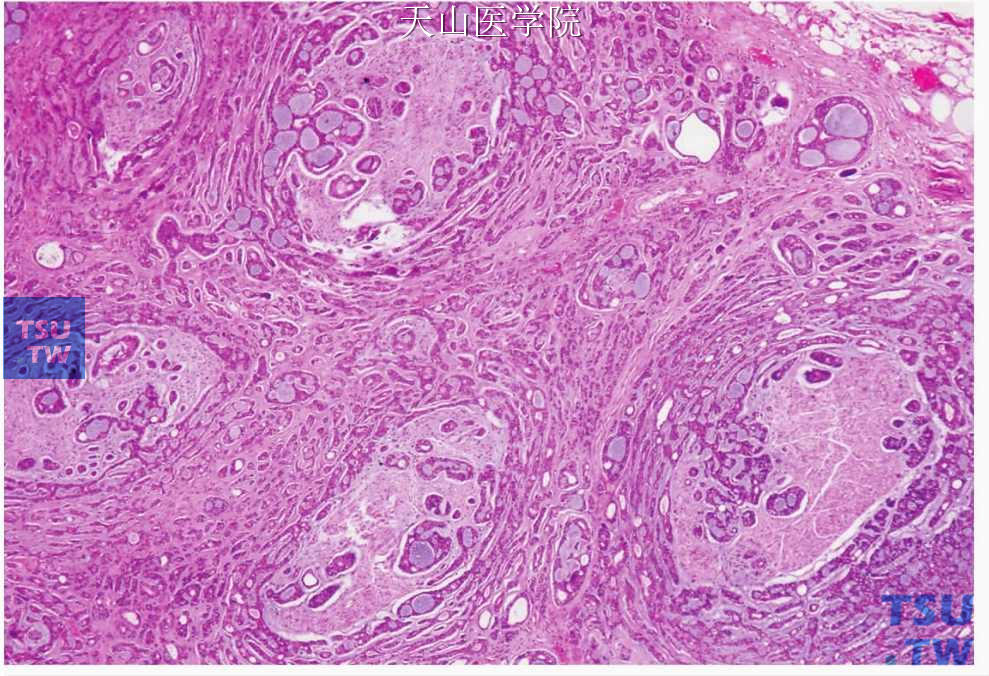
图7-145 腺样囊性癌:肿瘤细胞浸润神经
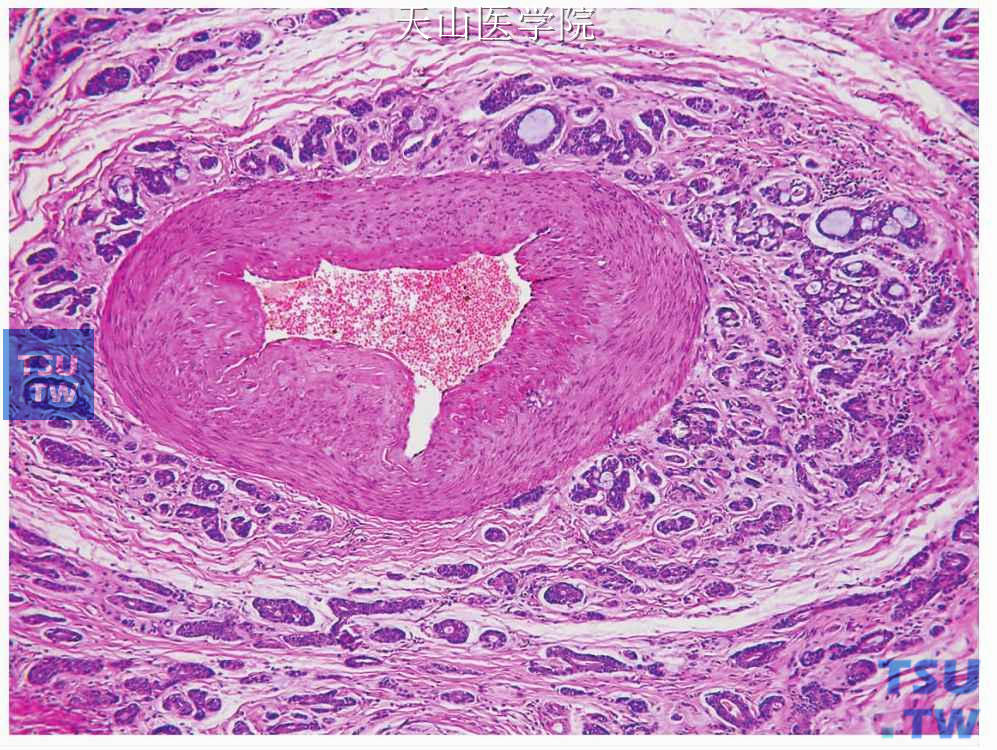
图7-146 腺样囊性癌:肿瘤细胞沿血管壁生长
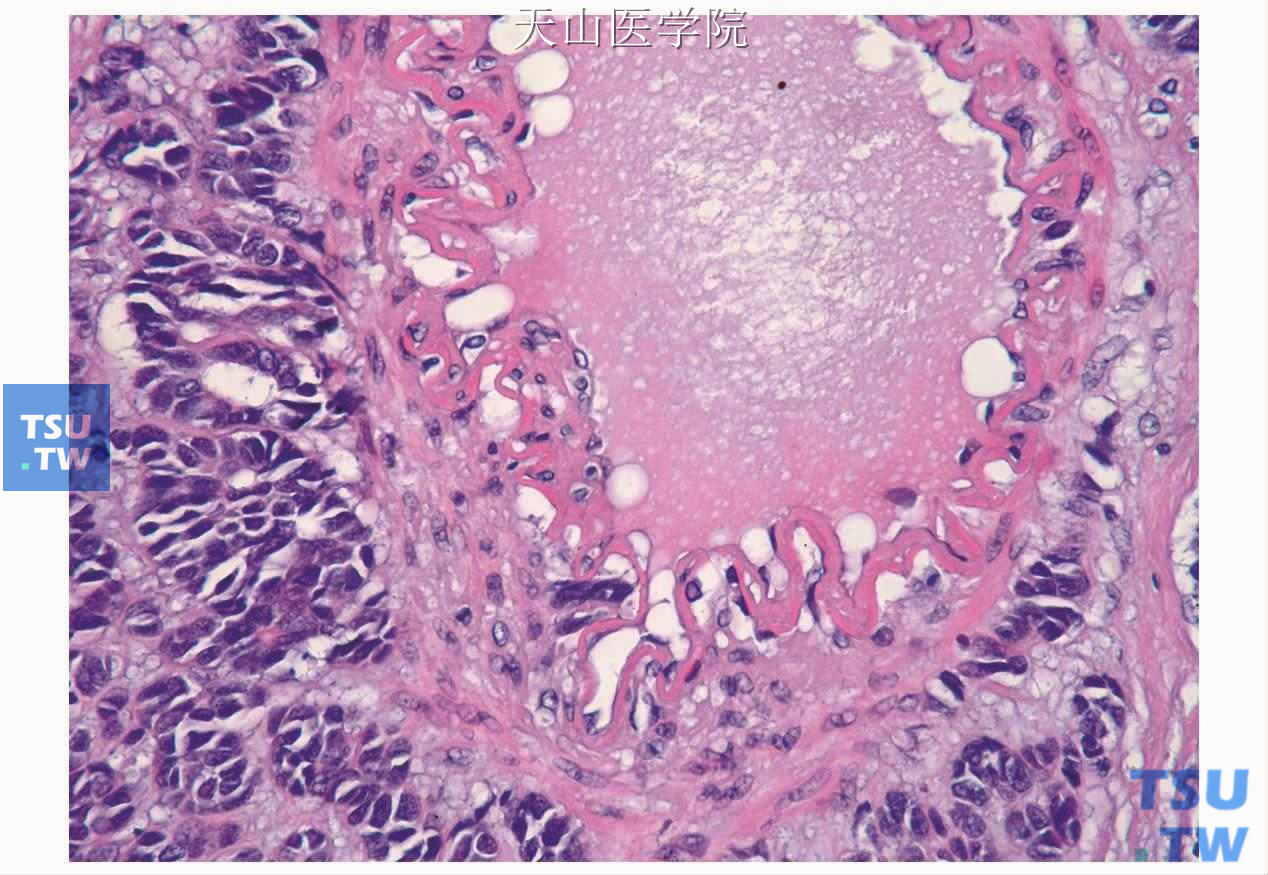
图7-147 腺样囊性癌:肿瘤细胞浸润血管
与许多其他肿瘤的分级不同,腺样囊性癌的分级相当简单,主要根据肿瘤的生长方式。早在1958年,Patey和Thackray就注意到实性型的预后不佳。以后就有了根据生长类型反映侵袭性的3级分类,即1级管状型、2级筛状型和3级实性型。一般来说实性生长占肿瘤的30%以上时即为3级。但是,实际上任何实性成分都意味着预后不佳,实性生长成分的百分比与预后呈线性关系。30%这个分界点是人为的。所以WHO的分级是按照肿瘤中占主导地位的生长方式来进行而不是数字式分级。几个系列研究结果显示,腺样囊性癌的分级具有预后价值。然而,关于分级是否是独立于临床分期的预后标志、腺样囊性癌分级对于治疗是否有价值还有争论。
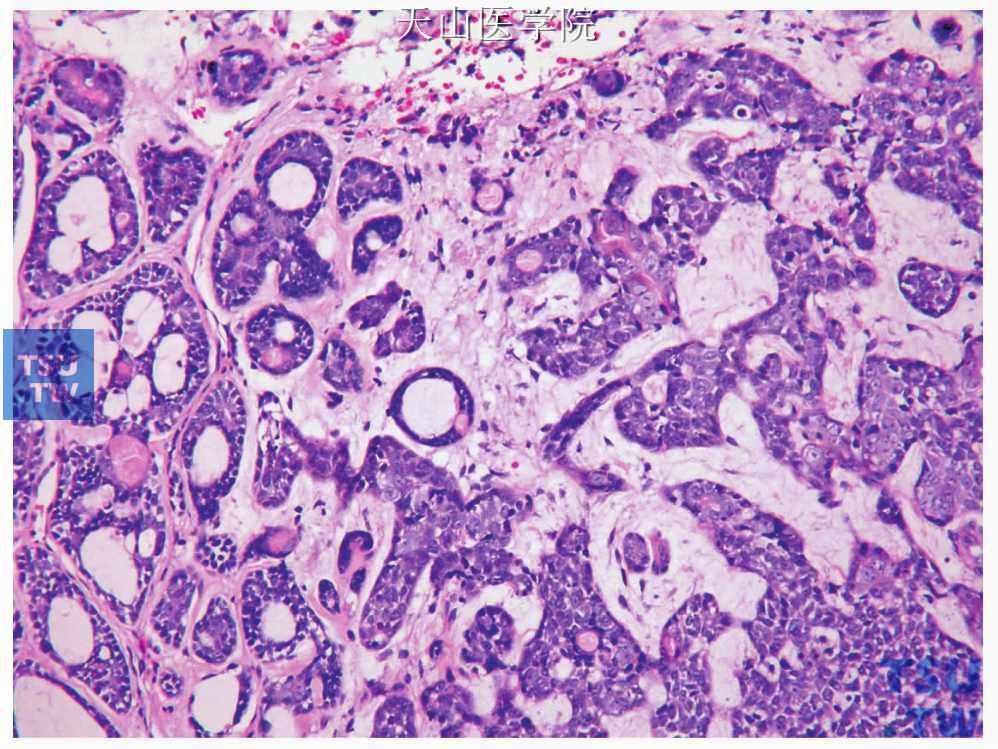
图7-148 腺样囊性癌高级别转化:腺上皮细胞增生明显(右侧)
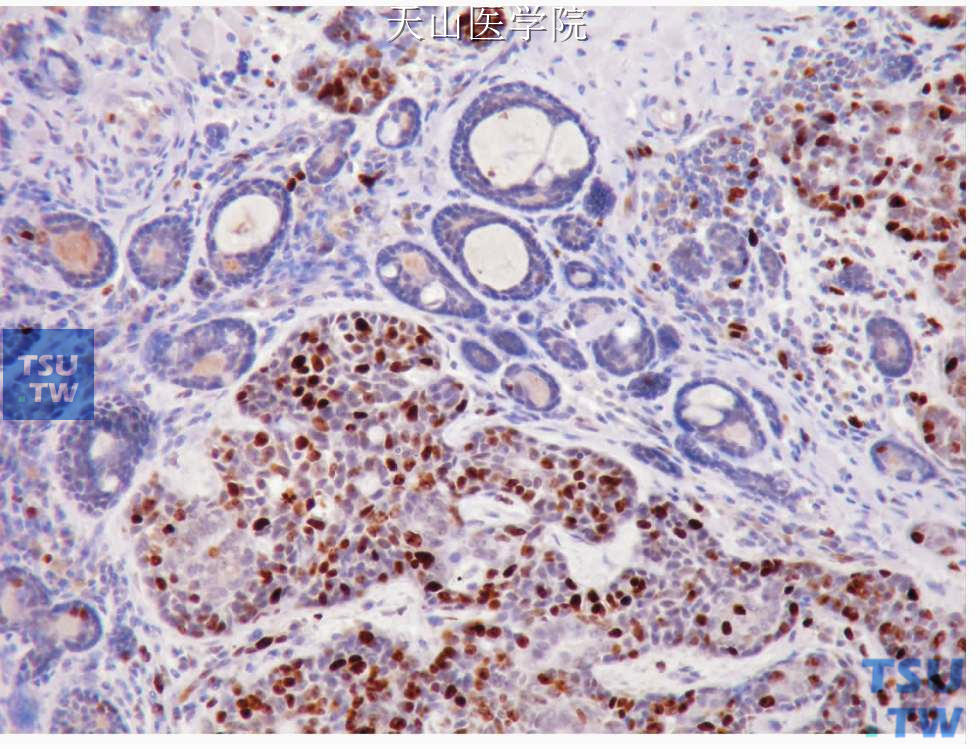
图7-149 腺样囊性癌高级别转化:高级别转化部分的Ki67阳性细胞明显多于非转化部分
腺样囊性癌伴高级别转化(adenoid cystic carcinoma with high grade transformation,ACC-HGT):腺样囊性癌的高级别转化指在普通的、任何级别的腺样囊性癌中出现多形性的、具有高分裂活性的高级别癌的结构成分。是一个罕见的高度侵袭性的腺样囊性癌变异型。高级别转化过去称去分化,常见的为低分化腺癌和未分化癌,还可见微乳头结构和鳞状分化。常规的腺样囊性癌不管是何种类型都由相对小的、细胞核有角的单形性细胞构成,而腺样囊性癌伴高级别转化中高度核分裂活性的高级别癌与普通的腺样囊性癌同时存在。普通的腺样囊性癌是具有导管细胞和肌上皮细胞的双相肿瘤,而腺样囊性癌伴高级别转化成分为纯的导管表型伴筛状或实性型腺样囊性癌成分,双相导管-肌上皮细胞分化模式丧失(图7-148、7-149)。普通的腺样囊性癌的特征性表现是小而深染的、大小一致的细胞核,较少的胞质,而转化成分的细胞核明显增大并且染色质情况不定。常见的特点有纤维结缔组织增生、核分裂、坏死多见及微小钙化。在常规的实性型腺样囊性癌和高级别转化成分间还是有部分形态学的重叠,而且二者之间的转化是逐步过渡的。Seethala等提出确定腺样囊性癌伴高级别转化的3个主要组织学标准:增生的肿瘤细胞伴有局部肌上皮细胞丧失、细胞核是普通管状型和腺样型腺样囊性癌细胞核的2~3倍、多数肿瘤细胞核核膜增厚并且有显著的核仁。有的学者根据转化区腺体形成的程度、细胞的多形性和核分裂活性将转化成分分成中分化腺癌和低分化腺癌,前者至少有2/3的转化区为腺体分化,后者腺体形成少或无腺体分化。遗传学方面,约40%的腺样囊性癌伴高级别转化有p53的改变,提示其在腺样囊性癌伴高级别转化的发生上有作用。最近的比较基因组杂交发现其有染色体8q24、17q11. 2-q12、17q23和15q11-13获得。8q24区含有C-MYC基因位点,即使在普通的腺样囊性癌也是常见的染色体获得的部位。侵袭性肿瘤的特点如细胞核的表现、间质特点、组织结构和免疫组织化学表现在转化的成分均较常规的实性型腺样囊性癌更明显。临床上高级别转化的腺样囊性癌往往预后不佳,平均生存时间为12~36个月,因此较普通实性型腺样囊性癌更差。淋巴结转移率超过50%,高于常规的腺样囊性癌,因此治疗上需做颈清扫。
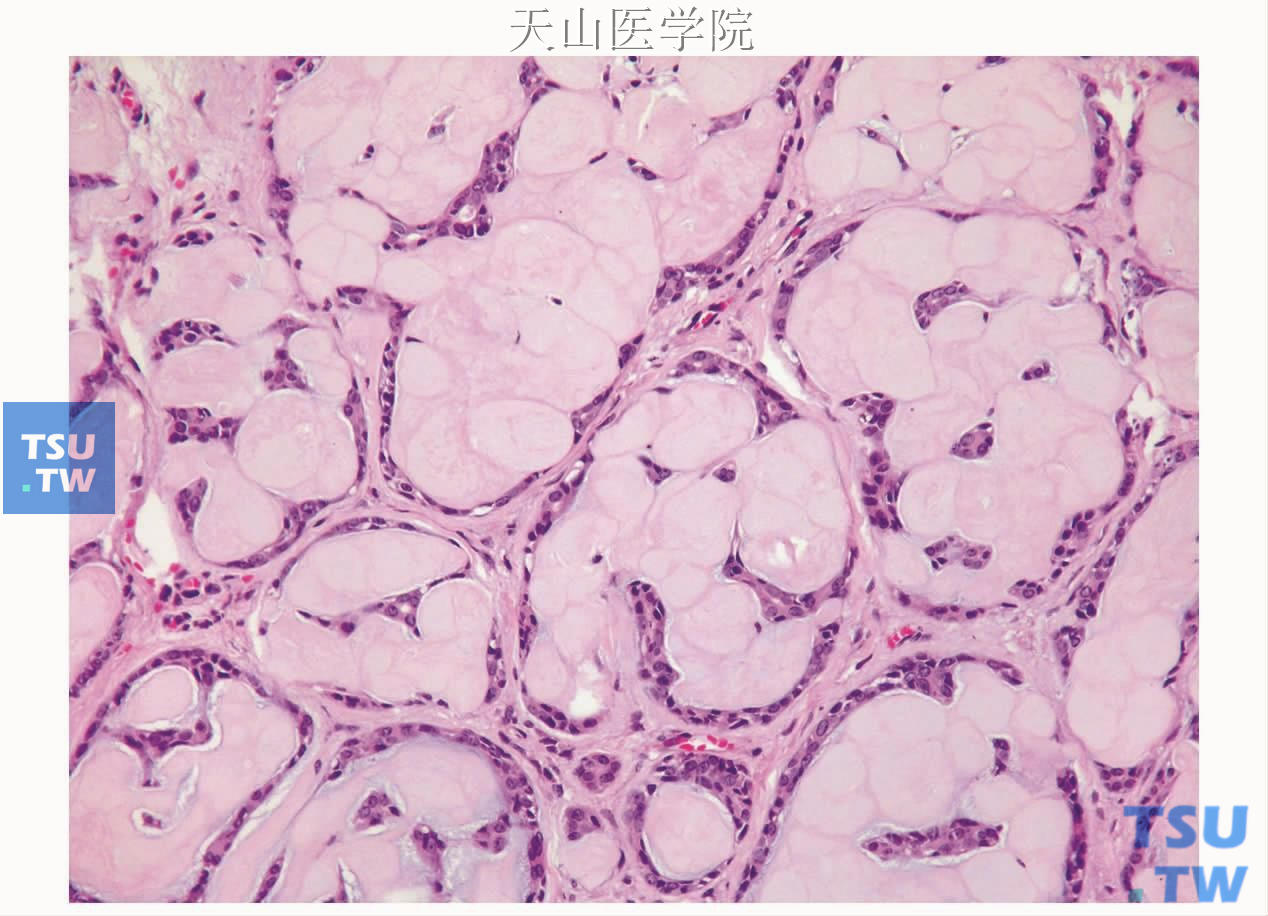
图7-150 硬化性腺样囊性癌:大量细胞外基质及少许肿瘤细胞
国外有学者建议,在病理报告中对腺样囊性癌进行分级时,应该报告主要的生长类型:管状、筛状或实性型;如果含任何实性成分,给出大概的比例;在说明中指出实性成分大于30%提示肿瘤的侵袭性行为;如果有高级别转化,在报告中应说明比例,建议也提示其淋巴结累及倾向。
罕见情况下由于细胞外物质的大量形成、细胞成分较少,肿瘤形成硬化性结节,称为硬化型腺样囊性癌(图7-150)。也有文献报道肿瘤间质出现含大量树枝样含黑色素的细胞、个别病例出现皮脂样细胞分化。此外,腺样囊性癌也常常是唾液腺杂交瘤的肿瘤类型之一,与之构成杂交瘤的肿瘤类型有肌上皮瘤、基底细胞腺瘤、皮脂腺瘤、黏液表皮样癌、唾液腺导管癌、囊腺癌(图7-151、7-152)。腺样囊性癌和上皮肌上皮癌的杂交癌报道较多,有人认为它们为同源的,可能不是真正的杂交瘤。
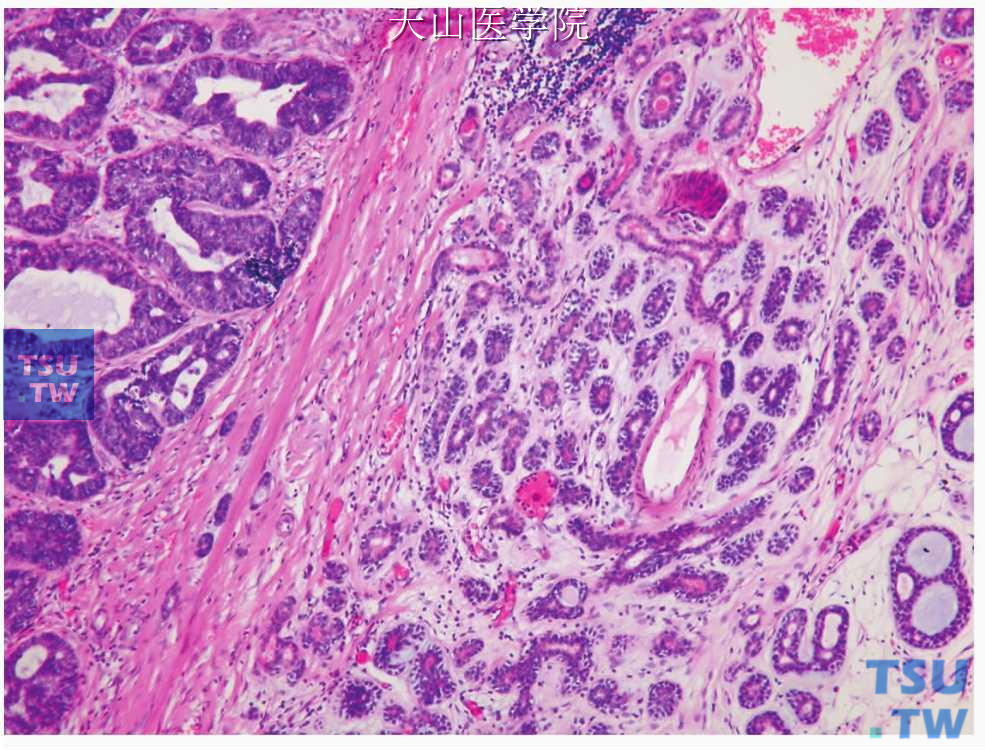
图7-151 腺样囊性癌与低分化腺癌形成的杂交瘤
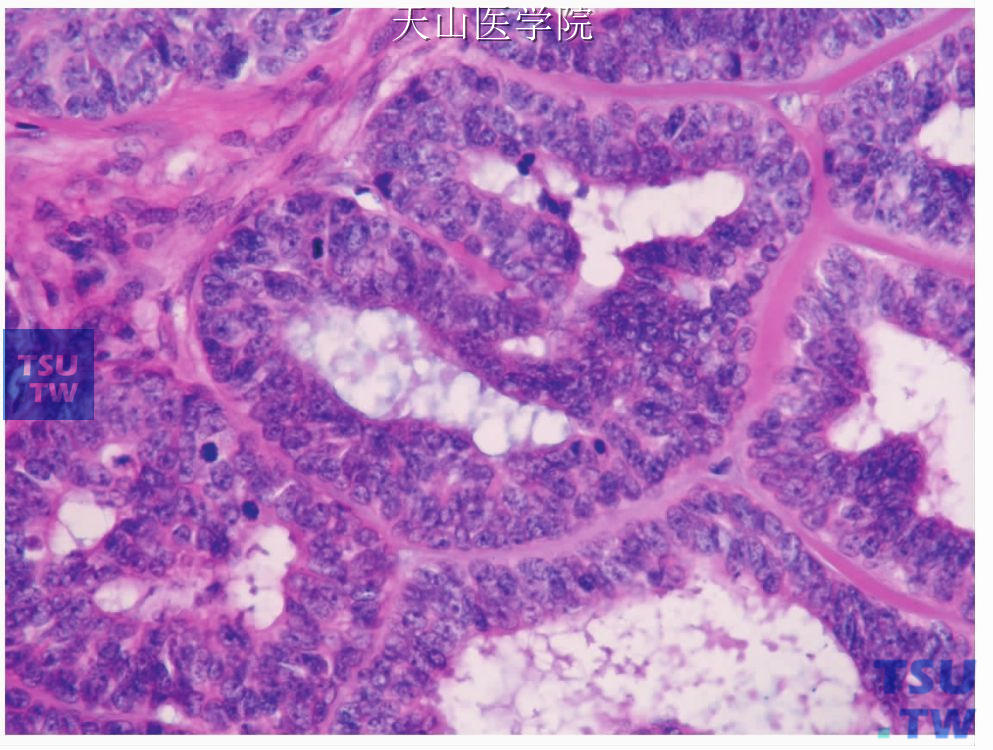
图7-152 腺样囊性癌与低分化腺癌形成的杂交瘤:腺癌中见较多的核分裂
免疫组化及免疫电镜
腺样囊性癌中闰管样腔面细胞CK7、CK8、CK14和CK19阳性。全角蛋白染色在导管细胞较肌上皮细胞强。导管细胞CEA和EMA阳性。对抗淀粉酶、乳铁蛋白、溶菌酶等可呈阳性反应,表明这些细胞具有分泌功能。肌上皮分化的细胞表达CK、vimentin、MSA、p63、SMA、平滑肌肌球蛋白重链和调宁蛋白。GFAP局部阳性。多数肿瘤呈S-100蛋白、MUC1、Rb蛋白和c-kit(CD117)阳性。E钙黏蛋白在实性型腺样囊性癌表达减少或是阴性。腺样囊性癌的细胞增殖不是很活跃,Ki67指数在不同研究有所不同,从3%~25%,一般在实性型者表达强。AgNOR计数在实性型常超过4,而在筛状型和管状型介于2~3之间。与细胞增殖和细胞凋亡相关的许多因子如PCNA、cyclin D1、p27、p16、mcm2、geminin、 bcl-2和DNA拓扑异构酶Ⅱα等在腺样囊性癌中也有较多研究,但在临床诊断和鉴别诊断中的价值尚不确定。腺样囊性癌中部分病例P53的免疫组化表达可阳性,研究结果不一致,多数属于低表达,个别高表达,阳性率达70%。cKit(CD117)在腺样囊性癌中的腔面细胞呈强阳性,曾有人提出其免疫组化染色有助于与多形性腺瘤和多形性低度恶性腺癌鉴别。但近来的研究显示cKit(CD117)的免疫染色对于区别腺样囊性癌和多形性腺瘤无帮助。因为ckit对于腺样囊性癌不具有特异性。多形性腺瘤和多形性低度恶性腺癌也可以是阳性,尽管不是强阳性。各种生长因子在腺样囊性癌中的表达也有较多研究。其中NGF的表达与神经侵犯有关、EGFR在腺样囊性癌中的表达率在不同研究有不同的结果。最近的研究表明,EGFR表达在管状型和筛状型的肌上皮细胞中,而在实性型中为阴性。
超微结构
电镜下腺样囊性癌有相对分化的闰管细胞、分泌细胞、肌上皮细胞和未分化细胞,有时还见鳞状细胞,相似于发育中腺体的终末导管。但肿瘤细胞主要向闰管细胞分化而不是向分泌细胞分化。筛状型的超微结构显示有2种腔隙:较多的是胞质膜围绕的含有细丝状黏多糖颗粒和指纹样排列的基底膜。有的中央含致密的核。另一种腔隙内衬的细胞有较多微绒毛,腔隙含有非细丝状均质物,属于真性管腔。细丝状和基底膜样物质相当于结缔组织黏液,而非细丝状物质相当于光镜下的上皮性黏液。癌巢周围有弹力样物质。肿瘤有大量肌上皮细胞参与。
遗传学
该肿瘤的遗传学异常较多,较早的研究发现腺样囊性癌常见6q的LOH,最近发现了涉及该染色体的易位t(6;9) (q21-24;p13-23),约在1/3的腺样囊性癌中存在。这个易位导致形成肿瘤融合基因MYB-NFIB。MYB是位于6q22-24的亮氨酸拉链转录因子,参与细胞增殖、凋亡和分化的调节。MYB在未成熟、增生的上皮、内皮和造血细胞高表达。MYB转录因子家族包括MYB,MYBL1(aka AMYB)和MYBL2(aka BMYB)。MYB蛋白对转录的调节通过3个关键功能域:N端DNA结合域、中心转录激活域和与转录抑制相关的C端负调节域。后者含一个亮氨酸拉链样模体,当受到破坏时会增加MYB的转录活性。MYB也是一个潜在的癌基因,在人的肿瘤中发生重排。MYB过表达已发现在胰腺、结肠、乳腺和造型系统恶性肿瘤。NFIB是一个位于9p23-24的人核因子Ⅰ转录因子,编码的蛋白的N端含有DNA结合域和二聚体域,富于脯氨酸的C端转录激活域。
MYB-NFIB融合导致MYB3'非翻译区(外显子15)缺失,此区正常情况下含有高度保守的某些microRNA包括miR-15a、miR-16和miR-150的靶序列,负责对MYB表达的负调节。MYB抑制的丧失导致融合转录和蛋白的过表达,使MYB的靶基因发生转录激活,这些靶基因与细胞周期控制(CCNB1、CDC2、MAD1L1)、细胞凋亡(API5、BCL2、BIRC3、HSPA8、SET)、细胞生长和血管形成(MYC、KIT、VEGFA、FGF2、CD53)和细胞黏附(CD34)相关。因此MYB-NFIB的转录靶点具有腺样囊性癌潜在的诊断标志作用,也可能是潜在的治疗靶点。不过,最近的一个关于PLGA的基因组不稳定性的研究中,发现9例PLGA中有1例出现MYB-NFIB融合基因,提示也许MYB-NFIB基因融合不是腺样囊性癌专有的基因改变。
关于KIT基因突变在腺样囊性癌中的检出率有不同结果。
表观遗传学改变包括:CKI基因常发生甲基化,包括P16启动子甲基化、p15、p18、p19、p21、p27的甲基化。p53的靶基因14-3-3(调节G2/M检测点)的甲基化提示由表观遗传学异常引起的细胞周期紊乱与腺样囊性癌的发生有关。其他的改变包括E钙黏蛋白启动子甲基化。出现甲基化的肿瘤与肿瘤的高级别和神经周侵犯相关。RASSF1A,DAPK DNA甲基化和MGMT启动子的甲基化与肿瘤的分级、临床晚期和转移相关。
小样本观察到其他的遗传学改变包括:CCND1扩增、CTNNB1(β-catenin基因)、AXIN1和APC基因突变、p53突变、12号染色体基因丢失。1p32-p36、6q23-q27、12q12-q14和19q缺失,9p21的LOH(含p16基因);还有22q13、16p、17q、8和18获得等。
对5例去分化腺样囊性癌的研究发现,去分化区常见染色体获得,染色体丢失只见于非去分化区。重要的获得包括8q24、17q11. 2-q12、17q23和15q11-13。主要的染色体丢失区为9q34、4p16、1p36. 1和11q22。荧光原位杂交分析见C-MYC(8q24. 12-q24. 13)扩增。比较基因组杂交示ERBB2(17q11. 2-q12)轻度增加,但免疫组化为阴性。
唾液腺腺样囊性癌的DNA倍体研究结果不尽相同。多数研究显示异倍体的腺样囊性癌占20%左右。实性型的异倍体比例较其他类型高,并且与预后相关。
鉴别诊断
多形性低度恶性腺癌:具有与腺样囊性癌相似的管状、筛状和实性生长方式和局部浸润性和沿神经扩展的特点,具有相似的上皮肌上皮细胞关系。许多肌上皮细胞标志物如HHF35、S-100、SMA、GFAP、p63均有表达,但其阳性率和染色强度均较在腺样囊性癌中低,阳性往往为斑片状。多形性低度恶性腺癌的结构为多形性和多样性,而腺样囊性癌的结构范围有限(实性筛状和管状)。乳头状结构、单列和单个细胞浸润是多形性低度恶性腺癌多形性低度恶性腺癌的而不是腺样囊性癌的特点。嗜碱性黏蛋白池是腺样囊性癌的常见特点,多形性低度恶性腺癌中少见。多形性低度恶性腺癌可以有实性区,但没有整体上见于腺样囊性癌实性区的“高级别”的感觉(粗糙的染色质、核分裂增加、凋亡和坏死)。多形性低度恶性腺癌中偶见核分裂,如果核分裂易见,则不考虑PLGA,因此Ki67指数可能有助于二者的鉴别。有研究其在多形性低度恶性腺癌平均为2. 4%,腺样囊性癌平均21. 4%,二者无重叠。EMA和CEA染色在腺样囊性癌腔面细胞阳性,而在多形性低度恶性腺癌大多数肿瘤细胞EMA阳性,只有少许细胞CEA阳性。
基底细胞腺癌:肿瘤细胞团块的外围细胞呈栅栏状排列,中央细胞较大,染色浅,排列疏松或呈旋涡状,细胞分化较差,常见核分裂像。
基底细胞腺瘤:基底细胞腺瘤的管状、小梁状或团块型的外周细胞均见栅栏状排列,与结缔组织之间有清楚的基底膜,在团块的中心排列较疏松,可见鳞状化生。个别的基底细胞腺瘤几乎全部由筛状结构构成,与腺样囊性癌非常相似,但腺样囊性癌有浸润性生长和神经周侵犯,而基底细胞腺瘤有包膜,无神经侵犯。但是如果是活检标本,二者的鉴别有时是不可能的,因为二者均表现为细胞形态温和、相似的上皮肌上皮关系、均可有管状和筛状结构。
多形性腺瘤:有时见腺样囊性癌样小灶,标本较小时可能给诊断造成困难,罕见情况下腺样囊性癌中也可有小的化生软骨灶。多形性腺瘤中的浆样肌上皮细胞一般在腺样囊性癌中不出现。鳞状化生可见于基底细胞腺瘤和多形性腺瘤,在腺样囊性癌中极其罕见。
小唾液腺基底样鳞状细胞癌:有基底膜样物质和实性区。BSC的基底膜样物质倾向于散在于肿瘤细胞之间,不集中在筛状结构的孔中。虽然腺样囊性癌中可见坏死和椭圆形核质比例高的基底样细胞,但单个细胞坏死、核分裂明显、大的细胞非典型性更常见于基底样鳞状细胞癌。局灶性角化、上皮钉突、表面上皮的异常增生/原位癌成分或表浅局灶性浸润性鳞状细胞癌,这些基底样鳞状细胞癌的特点在腺样囊性癌不存在。P63在腺样囊性癌呈区域性分布(主要染肌上皮细胞),基底样鳞状细胞癌则呈弥漫性阳性。
预后
腺样囊性癌的特征是侵袭性强,可侵犯腺体、肌组织、骨(图7-186)及骨膜;与血管关系密切,瘤细胞可与血管紧贴,常沿血管周围扩散,或侵入血管内形成瘤栓(图7-187、7-188),发生远处转移;易侵犯神经,且沿神经束衣蔓延(图7-185、7-186),因此临床上早期即可出现疼痛、麻木或面瘫等症状。研究显示约有60%(8%~98%)的病例出现神经侵犯,其预后价值在不同的研究有截然不同的结论。有的显示只有侵犯至肿物或腺外直径较大的神经才和预后相关,有的显示神经侵犯与预后的关系在单因素分析有关,但在多因素分析无关。
腺样囊性癌区域淋巴结转移率低,为10%~30%左右。应注意的是腮腺和下颌下腺腺样囊性癌常常直接侵犯腺体内和邻近的淋巴结,而不是转移至这些淋巴结。腺样囊性癌血行转移多见,大概占40%。常转移至肺、肝、骨及脑,其他的转移部位有皮肤、脉络膜、肾脏、卵巢、胃和胸膜等,有的患者发生多次、多脏器转移。Spiro统计196例腺样囊性癌,74例(38%)发生远处转移。发生远处转移者54%的生存时间在3年内,但也有10%超过10年,最长达16年。无瘤间隔期从1月至19年,平均36个月。影响生存率的因素有肿瘤大小、局部和颈部复发和淋巴结累及。
组织类型与预后密切相关,根据WHO分析的资料,腺样型、管状型的复发和转移率为14%~36%,8年生存率为57%~100%;实性型的复发率为70%,8年生存率仅有30%。肿瘤发生部位与预后有一定关系,小唾液腺肿瘤的预后比大唾液腺好,俞光岩总结的病例中,小唾液腺肿瘤的5年生存率为78. 1%,而大唾液腺肿瘤仅48. 2%,其中又以下颌下腺预后最差,远处转移率达60%,其中1/3出现骨、肝转移,5年生存率仅有27. 3%。
