精子运动功能的实现与精子结构紧密相关,只有结构正常的精子才具有良好的运动功能和受精能力。精子的结构在光镜下,大体分为头尾两部分。精子的核位于头部,由染色质高度浓缩而成,内含遗传物质。精子尾部是精子的运动装置,决定精子的运动功能。正常成熟的精子均具有正常的尾部结构,大致分为4部分,从连接精子头部至精子尾部末端将尾部分为颈段、中段、主段和末段,每一段均有特殊的细胞器存在,详细结构见第一章。
双微管复合物的三维结构
放射辐和连接蛋白丝
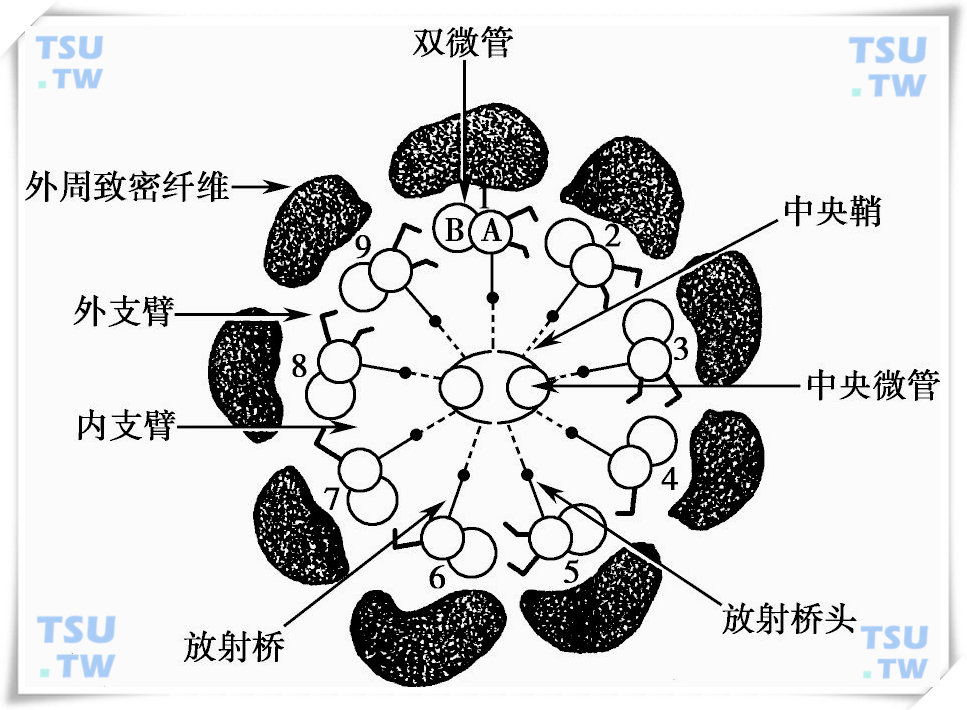
放射辐(radial spokes)和连接蛋白丝(nexin filaments):放射辐最早由Afzelius(1959年)和Gibbons等(1960年)报道。放射辐附着在A型亚微管上,在尾部的横切面上呈向心性突向中央微管。每一放射辐具有一5nm×33nm的细杆状和5nm×15nm的球形头状结构,形似锤或棒糖。它成对排列,相邻两对间隔距离70nm,见图下图。
精子尾部超微结构
连接蛋白丝是一种长而细的丝状结构,横穿邻近双微管致密纤维的复合物之间。Gibbons(1965年)认为连接蛋白连接邻近的A型亚微管,又称为连接蛋白纤维(nexin fibers),后来进一步证实连接蛋白纤维沿双微管以96nm的间距附着其上。连接蛋白仍难具体界定它的结构,对它的一个重要证据是当使用化学方法选择性地溶解其他轴丝的基质结构时,9对微管依然保留它的柱状排列。连接蛋白可能通过接触或连接每一对微管的A型和B型亚微管而影响整个微管。连接蛋白丝在轴丝中有2个主要功能:①当轴丝处在静止状态时,起到维持9对微管呈柱状排列的功能。②在滑行期间,连接蛋白调节相邻微管之间的位移,作为一种弹性成分起作用。
动力蛋白臂(dynein arms)
以成对方式附着在A型亚微管并突向邻近B型亚微管,这一发现由Afzelius(1965年)首先提出。Gibbons和Grimstone等(1970年)的实验进一步证明,动力蛋白臂沿微管表面呈两排向周边伸出,它由动力蛋白ATP酶组成。动力蛋白臂通常不易附着在B型亚微管上,内外两侧动力蛋白臂形态和化学成分各异,外侧臂呈钩型末端。此外发现,外侧臂与内侧臂错位9nm,更靠近尾部末端。两侧动力蛋白臂的间距为24nm。动力蛋白由相对分子质量为350 000的3种形态的亚单位组成,见下图。
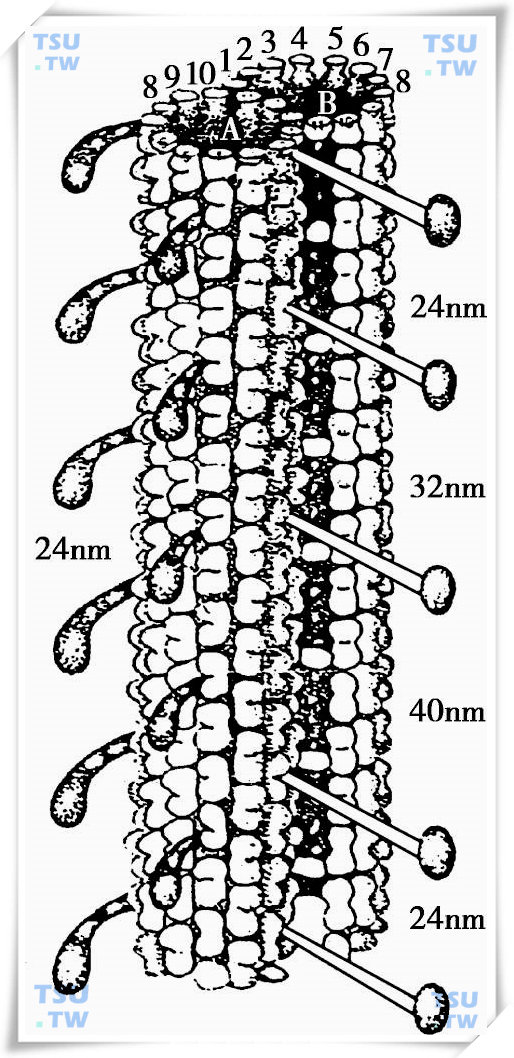
精子双微管复合三维模型
中央微管复合物的超微结构
鞭毛或纤毛在轴丝的中央有一对微管,有些种族的鞭毛缺乏中央微管(9+0轴丝)或中央微管由一种单一的致密核心物质所取代。如果将中央微管有关基因敲除后,结果导致运动丧失。因此认为放射辐和中央微管间的相互作用调节动力蛋白介导的外侧微管间的滑行。Warner和Satir(1974年)发现放射辐附着和去附着至中央鞘正好发生在纤毛轴丝的弯曲部分,推测这一机制与微管滑行、轴丝运动有关。在横切面上,两个中央微管紧密相连处有一短桥相连,长约6nm,有时在切片上发现这一桥连是断开的。
中央鞘
中央鞘(central sheath)是不与微管发生直接联系的辅助结构,细丝状网与中央微管相连,排列有序,实际上是附着在中央微管上的一排排突起物,突起长约18nm,沿中央微管轴以16nm间距排列。
线粒体鞘
线粒体鞘位于精子尾部中段,围绕外周致密纤维呈紧密螺旋状排列。在人类精子,线粒体鞘只占相对较短的中段部分,大约有15圈。线粒体的形态与其他哺乳动物的精子相似,线粒体内膜向线粒体内折叠形成许多小嵴,嵴的排列与线粒体长轴相平行,嵴间充满线粒体基质。基质致密,内含许多酶系统,是形成高能磷酸化合物三磷酸腺苷(ATP)的部位,也是精子运动的主要供能站。
