每一种甲状腺疾病均与碘有直接或间接联系。碘缺乏可引起非毒性甲状腺肿、甲状腺结节、甲状腺肿瘤;碘过多可导致甲状腺炎、诱发Graves病、淋巴细胞性甲状腺炎、碘甲亢及碘甲减;碘过多还与甲状腺毒性结节、非毒性多发性甲状腺结节等有一定关系。除饮食中碘含量高,食盐碘化过度外,必须注意含碘药物(如胺碘酮,amiodarone)、含碘造影剂甚至放射性碘标记性抗体或药物(放射免疫抑制治疗)所致的碘过量。
缺碘是人类的公共健康问题
碘在自然界中分布广泛。海水的含碘量平均为50μg/ L,而内陆水中的含碘量仅为海水的1/10(5μg/L)左右;雨水中的碘含量可能更低,一般不超过2μg/L。大气中的碘含量相差悬殊,以海风中的碘含量最高,可达100μg/m3,而内陆空气中的碘含量仅1μg/m3左右。地面表层土壤中的碘含量较高,一般为3~9mg/kg,而岩石中的碘含量要低得多。

海带富含碘
海产食盐的碘含量较高,可达200μg/kg。高原山区因海风不易到达,土壤中的碘盐被雨水冲洗流失,可导致饮水和食物中的碘含量不足。海产食物中的碘含量明显高于其他食物。例如,海带的碘含量可达2mg/kg,海鱼和贝类的碘含量80~500μg/kg,一般食物的碘含量均在50μg/kg以下。
含碘药物对机体碘代谢和甲状腺功能的影响相当明显,见下表。
含碘药物的碘含量
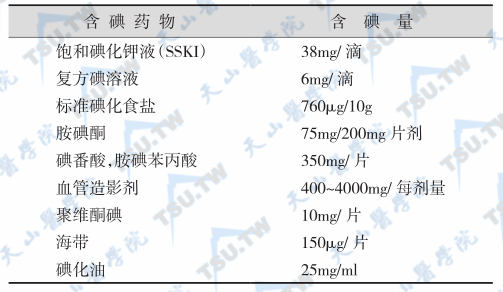
由于地区、生活习惯和环境、个体生理需要量等的差异,国际上没有规定统一的碘需要量和供给量。曾经提出的最低生理需要量为75μg/d,但供给量一般应为生理需要量的2倍左右,以预防缺碘性甲状腺肿的流行。意大利的供给量为110μg/d(女性)、140μg/d(男性)。我国地域广阔,自然环境中的含碘量差别很大,一般认为碘的安全摄入量范围为200~500μg/d。对多数地区和人群来说,在生长发育、妊娠期或哺乳期均应适量补充碘盐,使碘摄入量达到或超过200μg/d。
乳汁中的碘含量与母亲的饮食碘量相关,差异甚大,而婴幼儿的甲状腺储存量很低,因而其对乳汁中的碘含量很敏感。一般认为,乳汁中的合适碘含量为100~150μg/dl(伊朗、美国、中国和少数欧洲国家)但法国、德国、比利时、瑞典、西班牙、意大利、丹麦、泰国和扎依尔的乳汁中的碘含量均低于100μg/L;因此,WHO/ICCIDD/UNICEF推荐,乳汁中的碘量应达到250μg/L,以保证婴幼儿的碘供应充足。
全世界约有8亿人口生活在缺碘地区,约有近2亿人患有与碘缺乏有关的甲状腺肿。经过近半个世纪的补碘防治,目前在一些发达地区已基本控制了碘缺乏病的流行,但缺碘仍然是21世纪的重大社会和卫生健康问题。
胎儿/婴幼儿缺碘导致脑发育障碍
有机阴离子转运多肽1C1(organic-anion-transporting polypeptide,Oatp1C1)具有底物依赖性和相互竞争性特点,其缺陷可引起ADH(Allan-Herndon-Dudley)综合征(脑细胞发育障碍所致)。OATP1C1、单羧酸盐转运体8(MCT8)、MCT10、Oatp ICI和L-氨基酸转运体(LATs)是T4的特异性转运体,T4通过血-脑屏障的关键转运体。这些转运蛋白突变导致精神运动性障碍(psychomotor retardation)及脑细胞缺碘,对迅速生长的胎儿神经系统特别是大脑发育危害极大,常造成不可逆性神经系统损害(呆小病),而Pendred综合征是由双等位基因SLC26A4突变引起的常染色体隐性遗传性疾病,亦常伴有碘的缺乏和缺碘性甲减。
长期缺碘和碘过多导致甲状腺结节或甲状腺功能紊乱
长期缺碘或碘过多均可导致甲状腺结节、甲减或甲亢,这主要是由于甲状腺功能的自身调节和碘的毒性作用所致。
长期缺碘
可导致缺碘性甲状腺肿和甲状腺结节,由于缺碘和TH分泌减少,TSH分泌增加,甲状腺呈代偿性增生。另外,结节形成可能还与甲状腺生长免疫球蛋白(thyroid growth immunoglobulin,TGI)、细胞生长因子免疫因子、IGF等不依赖TSH而具有局部促细胞增生作用有关。因此,甲状腺细胞增生实际上分为两类:一类是TSH依赖性的,称为“非瘤性增生”(nonneoplastic hyperplasia),结节内的甲状腺滤泡细胞为多克隆性;另一类不依赖于TSH,细胞为单克隆性(真性瘤)。在大约60%的甲状腺结节中可发现TSH受体的活化性突变,引起毒性结节性甲亢,而临床上所见的“冷结节”可能伴有NIS的功能障碍或Tg的碘化缺陷。
碘过多
碘过多时,很多机制参与机体正常甲状腺激素水平的调控。其中最关键的是Na+/I-同转运体(NIS)。过多的碘使NIS关闭从而节流碘向甲状腺细胞内转移(激素合成的关键限速步骤)。而在NIS发挥作用前,细胞内碘的超负荷还能使碘的有机化过程被阻断(Wolff-Chaikoff效应)。碘超负荷时,部分长期接受放射性碘治疗的Graves病个体NIS关闭失效,使细胞内碘持续增高,随之出现甲状腺功能低下。部分长期缺碘的甲状腺肿患者碘超负荷时将出现甲状腺功能亢进症,这是由于这些甲状腺肿内可能含有一种能激活TSH受体的体细胞突变结节。当失去垂体调控作用时,碘超负荷将使这些甲状腺肿患者产生过量的甲状腺激素,从而出现碘甲亢。在遗传性TH合成障碍的基础上,加上大剂量碘对甲状腺功能的抑制作用而发生。碘过多引起的甲减多属可逆性,解除碘对TH合成与释放的抑制后,甲状腺功能可恢复正常,或通过代偿作用达到基本正常。以碘化食盐形式摄入安全剂量的碘可引起甲亢,除Graves病发病率增加外,其他类型的甲亢,如高功能性甲状腺结节、多发性毒性甲状腺肿等均呈增加趋势,碘化食盐还可使甲亢的病因学类型发生改变。
碘缺乏流行地区补给碘盐后,重度缺碘性甲状腺肿伴结节者似乎特别易于发生毒性结节或毒性甲状腺腺瘤。毒性多结节性甲状腺肿(toxic multinodular goiter,TMG)的结节形成与功能亢进亦与碘有关,而结节进展为自主功能性则与补给大量碘剂有关。碘甲亢的发病基础是由于结节中产生功能自主性甲状腺滤泡上皮细胞,当此类细胞呈优势生长并增生到一定数量后,可形成结节甚至发展为腺瘤,在碘供给充足条件下,即可引起甲亢。
碘诱发Graves病或AITD
碘与AITD有一定关系。碘可诱导或增强甲状腺滤泡细胞表达TNF-α等细胞因子而导致Graves病或慢性淋巴细胞性甲状腺炎。碘充足地区的AITD发病率明显高于碘缺乏地区,美国马萨诸塞州乌斯特市老年妇女的抗甲状腺微粒体抗体(TMAb,MCA即TPOAb)阳性率为25%(碘充足区),而意大利Reggio Emilia市TPOAb的阳性率为1%(缺碘地区)。国内高碘地区的抗Tg抗体(TgAb)阳性率为6.1%,碘充足地区为3.7%,而且Graves病的发病率亦明显高于缺碘地区。地方性甲状腺肿患者在补碘后,甲状腺出现淋巴细胞浸润、自身抗体滴度升高,说明缺碘对AITD和Graves病是一种“抑制”因素。当患者暴露于充足碘饮食环境中时,许多患者易于发病或使亚临床状态进展为临床状态。全球50年来,由于补碘措施的广泛应用,伴随的AITD发病率不断攀高,两者有某种密切病因联系。
Graves病患者甲状腺NIS的表达增加3~4倍,慢性淋巴细胞性甲状腺炎(慢性淋巴细胞性甲状腺炎)患者则表达减少。这些作用可能与TSH受体抗体有关。Graves病患者体内的甲状腺刺激性抗体通过cAMP介导,促进NIS的表达。Graves病在治疗过程中,如补充过量碘剂,易于导致复发。Solomon曾于1973年和1987年两次随访494例Graves病患者20年间的药物、缓解率与碘摄入量之间的关系,缓解率由1963年的60%~80%降至13%~20%;20年后,甲亢的缓解率又回升到50.6%。同样,手术治疗者在补充碘剂后亦易于复发,故提出补碘超过200μg/d可增加AITD的发病率。碘致AITD的机制未明。碘可刺激B淋巴细胞产生免疫球蛋白,促进巨噬细胞活性及巨噬细胞和树突样细胞(dendritic cell)的抗原呈递功能。另外,Tg分子碘化增加也使其自身抗原性加强,在特定条件下,碘还刺激甲状腺滤泡上皮细胞转变为抗原呈递细胞。
多种AITD患者体内存在NIS抗体,其含量在GD中高于桥本甲状腺炎(Hashimoto thyroiditis),NIS的抗原表位包括ExMD-8、-11、-12、-13。从慢性淋巴细胞性甲状腺炎患者血清提取的IgG能抑制甲状腺14%~60%的摄碘活性。因此,这种抗体在AITD患者甲减状态的发生中发挥重要作用。而Graves病患者NIS表达增加和NIS抗体在Graves病发病机制中的作用还待进一步探讨。
胺碘酮引起碘甲亢或碘甲减
胺碘酮(amiodarone)对甲状腺的不良反应与本药的疗程和累积用量有关。胺碘酮含碘丰富,有机碘占分子量的37.2%,其中的10%经脱碘可产生游离碘化物,服用200~600mg/d的胺碘酮相当于服碘75~225mg/d,加上由饮食中摄入的碘,极易致体内碘池的迅速扩大,血浆和尿液的碘浓度可升高40倍左右,而甲状腺的碘廓清能力明显下降。
胺碘酮对甲状腺的影响
可归纳为如下数个方面:①抑制Ⅰ型5’-脱碘酶,外周组织中的T4向T3的转化减少,血T4和rT3升高(20%~25%)。应用胺碘酮1~4个月后,血T4升高约40%。②垂体的脱碘酶被抑制,T4的转化减少,TSH升高,这一现象主要发生于胺碘酮治疗后的1~3个月内,以后血TSH又往往降至正常,但TSH对TRH的反应性下降。③血T3下降,rT3升高。随着疗程的延长,胺碘酮相关性甲状腺功能异常的发生率急剧上升,功能异常程度也逐渐加重。血rT3可作为胺碘酮毒性的监测指标,但要排除甲亢、甲减、手术、糖皮质激素、β受体阻滞剂等的影响。在多数情况下,rT3升高3~5倍,提示胺碘酮已达到有效治疗剂量,>5倍提示已有药物中毒,当然也可用监测胺碘酮的血药浓度来协助判断。
胺碘酮相关性甲亢
可见于甲状腺肿及正常人,其特点是TRH兴奋试验无反应,其机制与碘甲亢相似,但亦与甲状腺内碘的自身调节障碍、免疫因子诱导的甲状腺炎有关。胺碘酮所致甲亢主要见于缺碘人群。病因分为两类:Ⅰ型是碘甲亢,TH的合成和分泌增加;Ⅱ型是胺碘酮对甲状腺滤泡的刺激和破坏作用,产生化学性甲状腺炎,使T3、T4释放入血所致。此类甲亢多为非持久性,用糖皮质激素治疗有效,其病因类同于亚急性甲状腺炎伴甲亢者。如治疗过程中,患者心率增快,心律失常再度出现要考虑胺碘酮性甲亢的可能。两型的鉴别要点是:①Ⅰ型的131I摄取率正常而Ⅱ型被抑制;②Ⅰ型的血IL-6正常或轻度升高而Ⅱ型显著升高;③彩色超声示Ⅰ型的甲状腺血流增加而Ⅱ型正常。胺碘酮相关性甲亢常使已有的心脏疾病加重。一般主张用甲巯咪唑加过氯酸钾治疗,131I治疗无效。
胺碘酮相关性甲减
胺碘酮亦可导致甲减。此与碘的Wolff-Chaikoff效应、甲状腺自身抗体、TSH分泌增多(胺碘酮治疗3个月内)、饮食中碘含量过高等因素有关。Drvota等的研究结果提示,胺碘酮与T3受体-α结合,在低浓度时,其与T3受体-α的结合为非竞争性,而在高浓度时,与T3受体的结合为竞争性。在用胺碘酮治疗心律失常时,其浓度多达到竞争性抑制T3受体-α的水平,这既是胺碘酮抗心律失常的作用机制之一,也是其导致甲减的根本原因。甲减多为亚临床型或轻度临床型。血TSH升高,总T4(TT4)、游离T4(FT4)和游离T4指数(FT4I)下降,总T3(TT3)和游离T3指数(FT3I)亦常降低,过氯酸钾排泌碘试验阳性。
胺碘酮偶尔引起严重的抗利尿激素不适当分泌综合征。
放射性碘诱发甲状腺炎
放射性碘可引起放射性甲状腺炎,这可能不是碘离子的直接作用,而是放射线对甲状腺组织损伤的结果。胺碘酮可导致亚急性药物损伤性甲状腺炎的发病机制未明,可能与碘过多有某种联系。此外,本药还可引起碘甲亢(见下述)。甲状腺肿患者应用碘剂后可诱发甲状腺炎,伴甲状腺自身抗体滴度升高;缺碘地区居民在补碘后,自身免疫性甲状腺炎的发病率亦明显升高。另外,亚急性甲状腺炎和慢性淋巴细胞性甲状腺炎患者摄入过量碘剂后,可通过甲状腺的Wolff-Chaikoff效应导致暂时性甲减。
急慢性重症疾病并发非甲状腺病态综合征
碘分别占T4和T3分子量的65%与59%。T4的主要代谢途径是转化为T3和反T3(rT3)。T4和T3的其他脱碘反应都将生成无生物活性产物。参与脱碘反应的酶可分为3类,见下表。
碘化甲腺原氨酸脱碘酶的比较
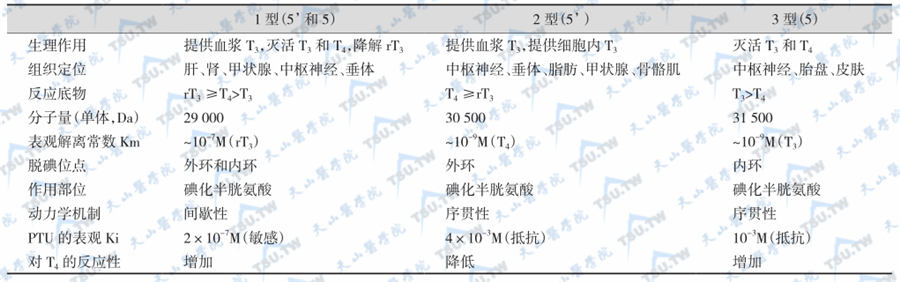
脱碘酶的调节是多重的、精细的。1型脱碘酶对T4的表观解离常数Km较高,说明在体内存在足量T4时,此酶未被饱和,对丙硫氧嘧啶(propylthiouracil,PTU)的抑制作用敏感。此酶活性在甲亢时增高,而在甲亢经治疗或甲减时降低。甲巯咪唑(thiamazole,他巴唑,tapazole)对此酶无作用,故PTU为严重甲亢,尤其是甲亢危象时的首选药物。2型脱碘酶主要分布于中枢神经系统中,主要保持组织细胞内T3的浓度恒定;同时也是腺垂体TSH细胞监测T3、T4浓度的一种重要机制。3型脱碘酶使T3、T4能及时被灭活,可能是使脑或胎儿不会因过量T4、T3而受到损伤的一种保护性机制。
正常情况下,40%的T4经脱碘生成T3,其中约40%生成rT3。几乎全部的T3和rT3是T4在外周脱碘生成的,甲状腺分泌的T3和rT3极微。T3主要经5-脱碘,而rT3主要经5’-脱碘酶作用生成DIT(T2)。饥饿、手术应激、应用糖皮质激素、糖尿病、严重感染等都可减弱1型脱碘酶的活性。类似的情况尚见于胎儿、新生儿、老年人、营养不良、肝肾功能不全、使用抗甲状腺药物、普萘洛尔、碘剂等,出现非甲状腺性病态综合征。
碘与其他疾病的关系未明
甲状腺良性毒性腺瘤的发病与碘缺乏和碘过多有关。芬兰、波兰、阿根廷和澳大利亚的资料显示,补充碘剂可使乳头状甲状腺腺癌的发病率升高,但其他甲状腺肿瘤,尤其是其他恶性甲状腺肿瘤与碘是否有关尚有待进一步明确。甲状腺癌细胞的hNIS表达明显减少,可能是甲状腺肿瘤细胞中摄碘活性下降的主要原因。临床上一些分化良好和大部分未分化甲状腺癌及其转移灶由于丧失聚碘功能,从而无法进行放射性碘治疗。维甲酸可上调人甲状腺癌细胞中NIS的表达,促进甲状腺癌细胞NIS的表达将为其核素治疗提供新的机会并增加疗效。
碘缺乏可导致乳腺小叶增生,碘(I2优于I-)可缓解纤维囊性乳腺病(fibrocystic breast disease)的病情。碘缺乏除可影响脑发育外,也可导致性腺功能障碍和生殖功能异常。
法定的食盐碘化需要地区化和个体化
1990年,世界儿童委员会(WSC)倡导在世界范围内普及碘化食盐,至1999年4月,有75%的缺碘国家以立法形式碘化食盐,地方性和缺碘性甲状腺疾病迅速减少,有些国家(如秘鲁)已经宣布消灭了碘缺乏病。
补充碘盐的最佳方法是碘化食盐的推广和应用,但经过数十年的观察,也带来了一些新问题,克服和预防碘相关性疾病已成为全球关注的新课题。美国100年来的碘与甲状腺疾病的流行病学资料对我国的碘相关性甲状腺疾病的防治有一定的借鉴意义。20世纪早期,美国的碘缺乏病流行严重,20年代开始用碘化钠治疗,甲状腺肿发病率从21%降至0.2%,多数居民的碘摄入量超过了有关标准。虽然地方性甲状腺肿已基本消灭,但同时出现了高碘摄入带来的一系列问题。最近20年来,美国居民的碘摄入量又明显减少,缺碘和碘过量并存。看来碘的需要量和供给量必须强调人群化与地区化。
滕卫平等对中国10个城市甲状腺疾病流行病学调查的结果显示,在15 181例城市社区居民(≥20岁)接受调查的人群中,贵阳、南京、武汉、西安4 个城市尿碘中位数(MUI)分别为228μg/L、282μg/L、207μg/L、241μg/L,处于碘超足量状态;北京、成都、广州、济南、上海、沈阳6 个城市MUI 分别为156μg/L、184μg/L、174μg/L、185μg/L、169μg/L、169μg/L,处于碘充足状态。10个城市各种甲状腺疾病总的患病率分别为临床甲亢1.1%、亚临床甲亢2.6%、临床甲减0.9%、亚临床甲减5.6%、TPOAb阳性率11.6%、TgAb阳性率12.6%、甲状腺肿2.4%、甲状腺单发结节11.6%、甲状腺多发结节7%。
比较碘超足量地区和碘充足地区的甲状腺疾病发病率发现,临床甲亢患病率分别为1.2%和1.0%;亚临床甲亢患病率分别为1.6%和3.2%,临床甲减患病率分别为2.1%和0.8%,亚临床甲减的患病率分别为8.2%和3.8%,TPOAb阳性率分别为12.4%和11.0%,TgAb阳性率分别为13.4%和12.0%,甲状腺肿患病率分别为1.3%和4.5%,甲状腺单发结节患病率分别为9.5%和13.3%,甲状腺多发结节的患病率分别为3.6%和9.6%。以上结果表明,碘超足量地区临床甲减、亚临床甲减、TPOAb和TgAb阳性率均高于碘充足地区;而甲状腺肿、甲状腺单发结节及多发结节、亚临床甲亢患病率碘超足量地区均低于碘充足地区。TPOAb阳性率在临床甲亢(51.5%)、亚临床甲亢(18.3%)、临床甲减(68.3%)、亚临床甲减(29.8%)患者中均显著高于甲功正常者(9.2%);TPOAb阳性者临床甲减及亚临床甲减的患病率均显著高于TPOAb阴性者,患病率分别为5.4%vs0.3%和14.4%vs4.4%。因此,我国城市人群碘超足量地区的临床甲减、亚临床甲减和甲状腺自身抗体的患病率显著高于碘充足地区。(崔蓉蓉 廖二元)
